Przepływ prądu elektrycznego jest nieodmiennie związany z ruchem ładunku elektrycznego. W przypadku cieczy i gazów jest to ruch jonów, a w przypadku ciał stałych ruch elektronów. Atomy tworzące strukturę ciał stałych są zbudowane z jądra atomowego, zawierającego protony i neutrony, oraz krążących wokół niego elektronów utrzymywanych przyciąganiem elektrostatycznym, jako że one mają ładunek ujemny a protony dodatni. Skąd więc w ciałach stałych elektrony, które mogą się ruszać?
Trzeba nam pamiętać, że elektrony poruszają się po orbitach w różnej odległości od jądra atomowego. Znamy z podręczników szkolnych opis powłok elektronowych, otaczających jądro niczym łuski cebuli, po których krąży po kilka elektronów, im dalsza powłoka tym zasadniczo więcej elektronów na powłoce. Model ten, można powiedzieć „planetarny”, bo narzucający skojarzenia z orbitami planet wokół Słońca, jest cokolwiek uproszczony. Podkreślmy to wyraźnie – nie tyle błędny, co uproszczony właśnie. Wiemy bowiem, że każda powłoka (oznaczana tradycyjnie numerami 1, 2, 3…, w miarę oddalania się od jądra) dzieli się na podpowłoki (oznaczane małymi literami alfabetu łacińskiego a, b, c…). Co więcej, położenie żadnej z powłok/orbit nie jest niezmienne.
[Eisenatom.svg: FornaxStylised_Lithium_Atom.png: Halfdanderivative work: Groogokk, CC BY-SA 3.0 Wikimedia Commons]
Przede wszystkim dlatego, że jeśli dany atom znajdzie się w sąsiedztwie innego, to protony tego drugiego też zaczynają przyciągać elektrony tego pierwszego i odkształcać trajektorie ich orbit. W skrajnym przypadku elektrony pierwszego atomu zaczynają krążyć wokół jądra drugiego i powstaje wiązanie chemiczne. Albo ten drugi atom przejmie jeden lub więcej elektronów tego pierwszego i oba będą miały liczbę elektronów nieproporcjonalną do liczby protonów i oba staną się jonami. Ale już nie wnikajmy w te tematy, bo oddalamy się od głównego wątku. Pragnę jeszcze tylko zauważyć, że w tym modelu właściwości elektronów pomijamy w ogóle kwestię fizyki kwantowej, która postrzega elektrony nie jako „kulki” krążące po orbitach, ale raczej fale, a do tego orbitę traktuje jako fragment przestrzeni, gdzie najprawdopodobniej przebywa elektron. Ale to już w ogóle wyższy poziom wtajemniczenia.
Wróćmy do zagadnienia zmienności orbit elektronowych. Mogą one ulegać odkształceniom także wtedy, kiedy dostarczymy im energii z zewnątrz. Innymi słowy, elektron może zmienić orbitę na inną. Ale nie ma lekko, nie może on sobie dowolnie zmienić orbity, dajmy na to o dowolną znikomą odległość oddalić się bardziej od jądra. Nie, nie, nie. Na poziomie cząstek elementarnych wszystko jest SKWANTOWANE, czyli poporcjonowane. To trochę tak samo, jak nie możemy kupić czegokolwiek za np. półtora grosza, ale możemy za jeden grosz lub za dwa. Po prostu nie ma pośrednich „porcji” pieniądza. Analogicznie z energią elektronów na orbitach – one mogą przyjmować tylko określone wartości.
[Patricia.fidi, Public domain, via Wikimedia Commons]
Dostarczenie elektronom odpowiedniej porcji energii (na przykład w taki elektron „uderzy” foton promieniowania elektromagnetycznego o określonej długości fali) oznacza tyle, że zmieni swoją orbitę na konkretną inną – mówi się wtedy, że z pasma podstawowego elektron wejdzie na pasmo wzbudzone. Używa się określenia „pasmo”, choć właściwie można by mówić o orbitach lub powłokach. Jakkolwiek termin „pasmo” jest powszechnie i tradycyjnie używany w tym właśnie kontekście.
To jaką energię posiada elektron jest tożsame z określeniem, jaką orbitę i w jakiej odległości od jądra może on przyjąć. Te orbity/pasma, na które może dany elektron wskoczyć nazywamy pasmami dozwolonymi, a te na które nie może nazywamy pasmami wzbronionymi. Piszę „dany elektron” ponieważ to zależy od tego jak oddziałują na dany elektron protony z jądra atomowego i inne elektrony je okrążające. To oznacza, że elektrony atomów w różnych pierwiastkach i związkach chemicznych będą miały różne poziomy dozwolone i wzbronione.
Jeśli dostarczymy elektronom odpowiednią ilość energii mogą one „wskoczyć” na wyższy poziom energetyczny (oczywiście w obrębie pasm dozwolonych), na tyle odległy od jądra atomowego, że praktycznie tracą z nim „łączność”. Są więc zdolne do migracji, co pozwala nam określić taki poziom elektronowy jako poziom przewodnictwa. Jeśli więc stworzymy taką sytuację, że do materiału zbudowanego z atomów pierwiastka/pierwiastków, którego elektrony (wystarczy, że tylko niektóre) znajdują się w paśmie przewodnictwa, przyłożymy napięcie albo umieścimy go w polu elektrycznym, to wymusimy ruch tych elektronów, które niczym żaglówki pchane po wodzie wiatrem, będą „się ślizgać” po tym paśmie przewodnictwa (w tym wypadku przyspieszane polem elektrycznym).
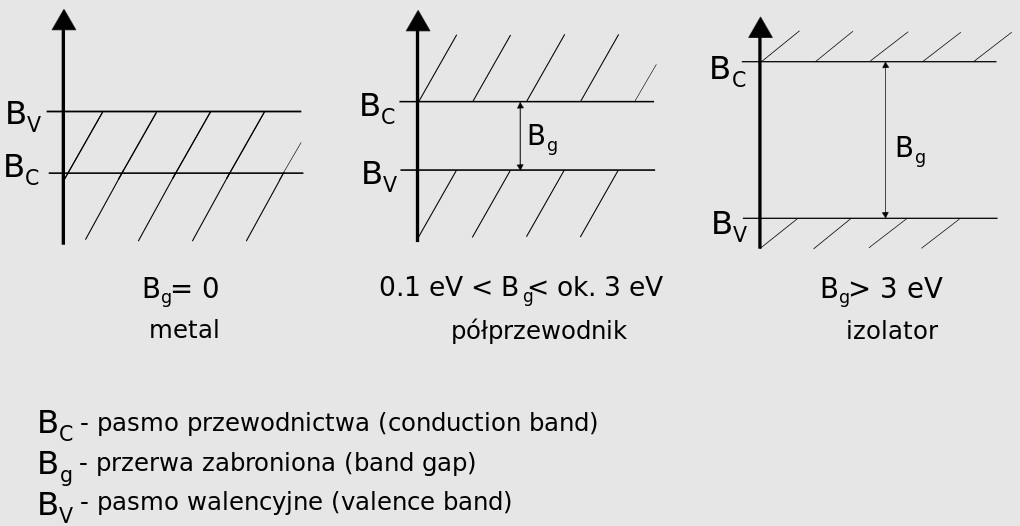
No dobrze, to tak z grubsza przedstawia się tzw. pasmowa teoria przewodnictwa. Zapewne już skojarzyliście, że skoro różne pierwiastki i związki chemiczne mają elektrony o różnych pasmach dozwolonych i wzbudzonych to na pewno będą miały też różne poziomy przewodnictwa. Otóż to. W tym właśnie tkwi przyczyna rozróżniania przez nas przewodników prądu elektrycznego, izolatorów oraz półprzewodników.
[MonteChristof at Polish Wikipedia, CC BY-SA 3.0, via Wikimedia Commons]
Przewodniki to materiały o takiej strukturze, w której pasmo przewodnictwa elektronów pokrywa się z pasmem podstawowym (inaczej walencyjnym), czyli już w stanie podstawowym, bez dostarczania dodatkowej energii część elektronów może sobie swobodnie migrować w materiale. Izolatory to z kolei takie materiały, w których pasmo przewodnictwa jest na tyle „wysoko”, że żeby przenieść na nie elektrony trzeba dostarczyć tak dużo energii, że prędzej sam materiał ulegnie zniszczeniu, bo na przykład rozerwane zostaną wiązania struktury krystalicznej.
Pośrednimi materiałami są półprzewodniki, w których wejście elektronów na poziom przewodnictwa jest możliwe, ale wymaga pewnego dodatkowego wspomagania. Ale o tym, pozwólcie, napiszę więcej za tydzień… 😉
Wojciech Smułek
