Światło bywa chemikowi bardzo przydatne. I to nie tylko dlatego, że dużo ciekawiej robi się eksperymenty, gdy jest jasno, a nie po ciemku. Światło ma kluczowe znaczenie w wielu reakcjach chemicznych, stanowiąc czynnik niezbędny do ich zajścia.
O naturze światła
Najpierw krótkie przypomnienie czym jest światło. Współczesna fizyka opisuje je modelem korpuskularno-falowym. W dużym uproszczeniu polega on na tym, że światło składa się z nieważkich (to znaczy pozbawionych masy) cząstek, zwanych fotonami. Są one stale w ruchu, przy czym strumień fotonów, a nawet pojedynczy foton, wykazują cechy fali (tak jak rozumieją to określenie fizycy).
[Adi4000[1], Public domain, via Wikimedia Commons]
Dla nas istotne jest, że fotony niosą ze sobą energię, przy czym energia ta nie zależy od masy cząstki (foton bowiem jej nie ma) ani od prędkości (bo wszystkie poruszają się z prędkością… światła!). Energia fotonu zależy od częstotliwości fali świetlnej, jaką on tworzy. Częstotliwość fali świetlnej jest odwrotnie proporcjonalna do długości tej fali. Dlatego podając długość fali lub jej częstotliwość możemy łatwo wyznaczyć jej energię. Zapamiętajmy tylko, że im krótsza fala tym większą energię ze sobą niesie.
Światło to jedynie wąski zakres fali elektromagnetycznych, które mogą być bardzo krótkie (np. fale gamma) albo niezwykle długie (np. kilometrowe fale radiowe). Fale świetlne mają długość od 380 do 780 nm. Fale krótsze to nadfiolet, a dłuższe od światła to podczerwień.
Rozrywanie wiązań
Światło padając na dowolną substancję może ulec przez nią pochłonięciu lub odbiciu. Z punktu widzenia chemika szczególnie ciekawa jest sytuacja, kiedy fotony mają dostatecznie dużą energię (to zwykle dotyczy światła nadfioletowego, UV), żeby oddziaływać z elektronami, które tworzą wiązania chemiczne.
Jak fotony oddadzą swoją energię tym elektronom, mogą one tak zmienić swoje orbity wokół jąder atomowych, że wiązania zostają zerwane i to w taki sposób, że przy każdym z atomów tworzących wiązanie zostanie jeden elektron.
Pamiętacie może z jednego z moich tekstów, co to oznacza? Tak, tak, powstają wysoce reaktywne wolne rodniki. Ten proces zachodzi szczególnie łatwo, gdy w cząsteczce mieliśmy wiązania wielokrotne, podwójne lub potrójne. Czasem rozerwanie wiązania prowadzi do tworzenia jonów – kationów i anionów, które również chętnie wchodzą w reakcje chemiczne.
Fotopolimeryzacja
Pomyślcie jakie to otwiera możliwości! Za pomocą światła o odpowiedniej długości fali możemy wytwarzać wolne rodniki lub jony w dowolnym miejscu i czasie. Tym samym mamy pełną kontrolę nad różnego rodzaju reakcjami. Do najbardziej znanych z nich należą reakcje tworzenia polimerów, nazywane fotopolimeryzacją.
Być może słyszeliście o materiałach/polimerach fotoutwardzalnych. Właśnie twardnienie tych materiałów, czyli przechodzenie z postaci ciekłej do stałej, polega na fotopolimeryzacji. Małe cząsteczki (tzw. mery) pod wpływem światła o odpowiedniej długości tworzą jony lub rodniki które błyskawicznie łączą się ze sobą tworząc długie łańcuchy polimerów.
Garść przykładów
Przykłady sytuacji, gdzie ten proces się wykorzystuje można by mnożyć. Drogie Czytelniczki zapewne kojarzą tzw. hybrydy (dla niewtajemniczonych, szczególnie tych płci męskiej – chodzi o rodzaj lakierów do paznokci). O ile w klasycznych lakierach do paznokci, lakier twardnieje po odparowaniu lotnego rozpuszczalnika, to w „hybrydach” ciekły lakier twardnieje pod wpływem naświetlania lampą UV.
Inny przykład zastosowania znajdziemy w… gabinecie dentystycznym. Mam na myśli plomby do zębów. Mam nadzieję, że nie musieliście z nich korzystać, ale jeśli tak to pamiętacie może, że te białe wypełnienia wymagały naświetlania specjalną lampą o niebiesko-fioletowej barwie. To właśnie był czynnik inicjujący sieciowanie polimeru, który z plastycznej masy stawał się twardy jak kamień. Co więcej, mamy także lakiery i farby światłoutwardzalne służące ochronie elementów metalowych i drewnianych.
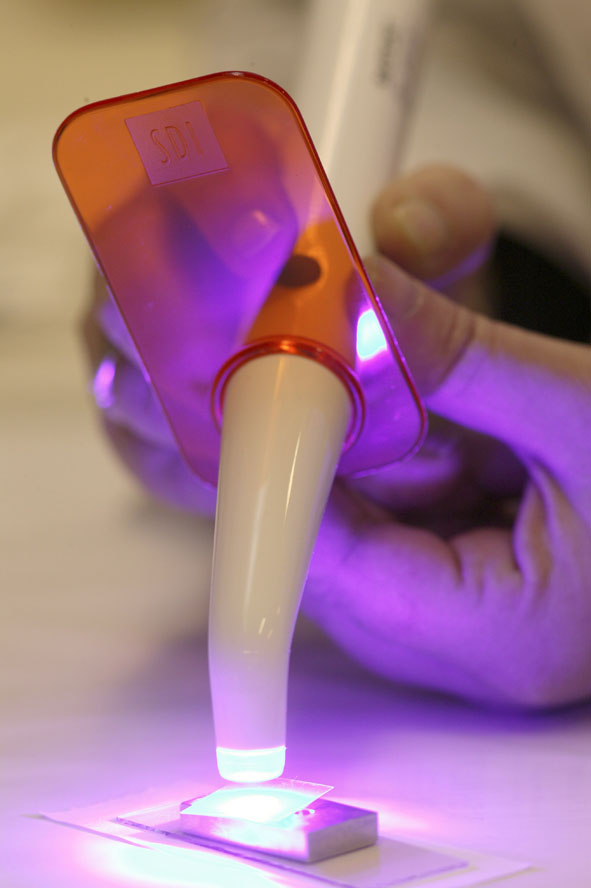
[Niomno, CC BY 3.0 via Wikimedia Commons]
Wielką zaletą polimerów fotoutwardzalnych jest to, że polimeryzacja zachodzi bardzo szybko. Nie trzeba na przykład czekać na odparowanie rozpuszczalnika, jak w klasycznym lakierze. Wygodne jest również to, że proces zachodzi tylko tam, gdzie przeprowadzimy naświetlanie. Po nałożeniu warstwy możemy też czekać z zainicjowaniem procesu praktycznie tak długo jak chcemy. Wspaniale, czyż nie?
Wspomnijmy jednak o wadach tego procesu. Po pierwsze proces wymaga stosunkowo drogich odczynników. Przewagą klasycznych polimerów i lakierów jest wciąż ich niższa cena. Drugą dyskusyjną sprawą jest sam mechanizm procesu. Wolne rodniki i reaktywne jony powstające w procesie naświetlania mogą być niebezpieczne dla naszego zdrowia. Nie chcę w tym miejscu oceniać, czy np. lakiery hybrydowe czy wypełnienia dentystyczne utwardzane światłem, są bardziej niebezpieczne od innych rodzajów lakierów czy plomb. Miejmy jednak świadomość, że polimery fotoutwardzalne mogą nie być tak całkiem obojętne dla zdrowia, jeśli będą niewłaściwie stosowane. Wszystko jest tak naprawdę kwestią rozsądku i świadomości z czym mamy do czynienia. A z tym ostatnim, po przeczytaniu tego tekstu, jest już myślę lepiej;)
Wojciech Smułek
