Zapoznając się z różnymi grupami związków organicznych bardzo często skupiamy się na ich najprostszych reprezentantach. Małe, nieduże cząsteczki amin, alkoholi, aldehydów i kwasów są bardzo dobrymi przykładami, ponieważ nie posiadają innych grup funkcyjnych i dzięki temu ich właściwości łatwiej analizować i porównywać.
Niestety, bardzo często brak czasu nie pozwala zaznajomić się z nieco bardziej złożonymi cząsteczkami o większej liczbie grup funkcyjnych. Dlatego dziś zajmiemy się cząsteczkami związków niezwykle powszechnych w przyrodzie, a mianowicie kwasami dikarboksylowymi.
Jak mawia przysłowie „każdy kij ma dwa końce” i podobnie jest z cząsteczkami tej grupy kwasów, ponieważ każda z nich zawiera na swoich końcach grupę karboksylową (-COOH). Stąd też w nazwie systematycznej takiego kwasu mamy „di”, i każda z nich kończy się na „-diowy”. Najprostszą taką cząsteczką jest kwas etanodiowy, ale powszechnie używa się jego zwyczajowej nazwy – kwas szczawiowy. To zresztą odnosi się do większości kwasów dikarboksylowych i dlatego nawet w publikacjach ściśle naukowych znajdziemy takie określenia jak kwas malonowy, bursztynowy, glutarowy czy adypinowy zamiast kwas propanodiowy, butanodiowy, pentanodiowy czy heksanodiowy.
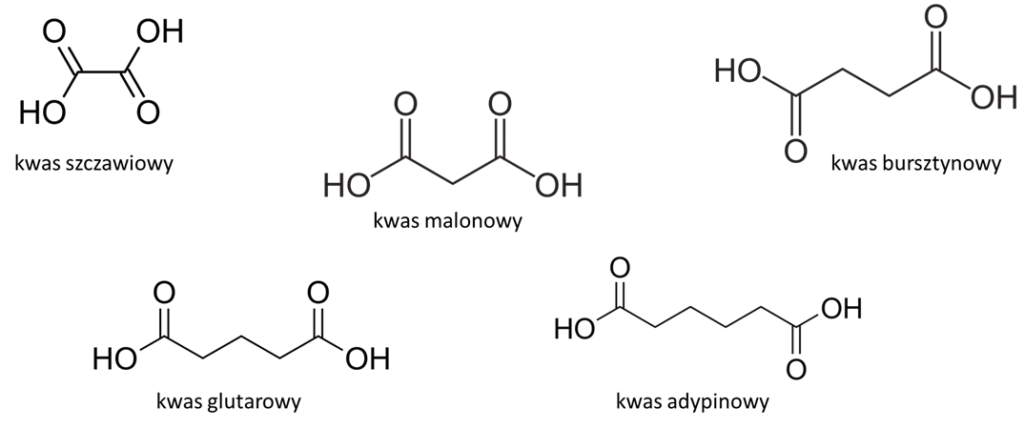
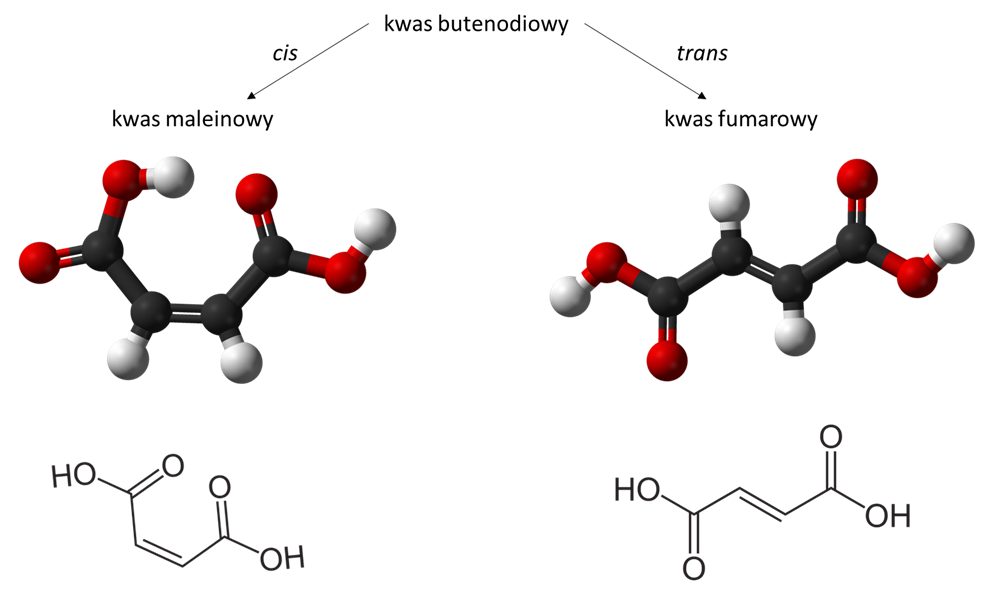
Wymienione kwasy mają liniową budowę i poza grupami karboksylowymi nie mają innych „udziwnień” w strukturze. Ale zdecydowanie nie wyczerpują puli kwasów dikarboksylowych, które występują naturalnie w przyrodzie. Mamy więc na przykład kwasy zawierające wiązanie nienasycone, jak kwas maleinowy czy fumarowy.
Na dobrą sprawę oba te związki mają taką samą budowę. Ich cząsteczka jednak zawiera wiązanie podwójne, które w przeciwieństwie do wiązania pojedynczego jest „sztywne” i nie pozwala na swobodną rotację fragmentów cząsteczki. To sprawia, że konfiguracja atomów w sąsiedztwie tego wiązania jest kluczowa i decyduje z jakim izomerem (konfiguracją) danej cząsteczki mamy do czynienia. W przypadku kwasu maleinowego grupy karboksylowe są po tej samej stronie cząsteczki, a w kwasie fumarowym po przeciwnych. Takie ułożenie grup funkcyjnych w cząsteczkach zawierających wiązanie podwójne nazywamy odpowiednio ułożeniem „cis” oraz „trans”.
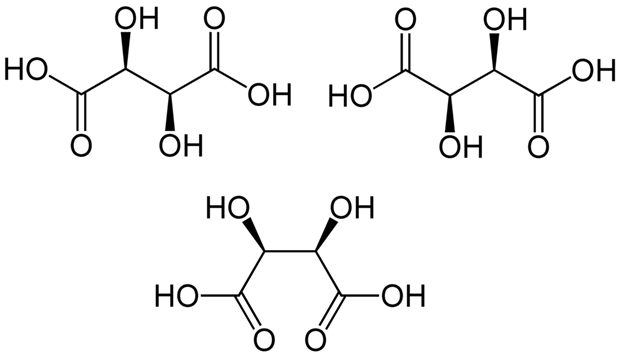
Kolejnym „dodatkiem” jaki spotyka się w naturalnie występujących kwasach karboksylowych jest grupa hydroksylowa (-OH). Powszechnymi przedstawicielami tej grupy są kwasy jabłkowy i winowy (zgadnijcie gdzie one występują 😉). Obecność grup hydroksylowych wprowadza nas w świat izomerów optycznie czynnych, to znaczy cząsteczek, posiadających jedną lub kilka osi symetrii lub nieposiadających ich w ogóle.
Odkrycie tych właściwości cząsteczek wiąże się z pionierskimi badaniami Ludwika Pasteura, słynnego naukowca znanego z odkrycia mechanizmu procesów fermentacji oraz opracowania szczepionki na wściekliznę. Przełomowość tych mikrobiologicznych osiągnięć Pasteura sprawiła, że często zapomina się o tym, że był on chemikiem i swoją naukową przygodę rozpoczął od badań nad właściwościami kwasu winowego, które doprowadziły go do odkrycia właśnie izomerii optycznej związków chemicznych.
[Jü, Public domain, via Wikimedia Commons]
Tak na marginesie dodam, że w grudniu tego roku przypada dwusetna rocznica urodzin tego wybitnego naukowca. Z tej okazji organizowana jest w listopadzie tego roku w Warszawie konferencja https://www.pasteur2022.com/ . Patrząc na program i prelegentów można być pewnym, że będzie to niezapomniane wydarzenie w którym będzie można uczestniczyć nie tylko na żywo ale i on-line, a więc praktycznie każdy może wziąć w nim udział.
Tym nawiązaniem do Pasteura kończę dzisiejszy tekst, ale do kwasów dikarboksylowych wrócimy na pewno w przyszłym tygodniu 😉 .
Wojciech Smułek
14.07.2022
