Kontynuując przegląd kwasów dikarboksylowych dziś poznamy bliżej aromatycznych przedstawicieli tej grupy związków. Pisząc o aromatyczności mam na myśli oczywiście nie ich zapach, ale aromatyczność w sensie chemicznym. Równie dobrze mógłbym więc napisać, ze chodzi o pochodne benzenu.
Najczęściej wykorzystywane są kwasy dibenzenokarboksylowe zwane potocznie ftalowymi. Do tej „chemicznej rodzinki” należą trzy związki różniące się wzajemnym położeniem grup kwasowych. Kiedy sąsiadują obok siebie to mamy kwas orto-ftalowy (w skrócie o-ftalowy), kiedy rozdziela je jeden atom węgla w pierścieniu to jest to kwas meta-ftalowy (m-ftalowy), a kiedy są naprzeciwko siebie mamy do czynienia z kwasem para-ftalowym (p-ftalowym). Jakkolwiek spotyka się często ich potoczne dawne nazwy. Wtedy kwas p-ftalowy to kwas teraftalowy, kwas m-ftalowy nazywany jest izoftalowym, a kwas o-ftalowy jest po prostu kwasem ftalowym.
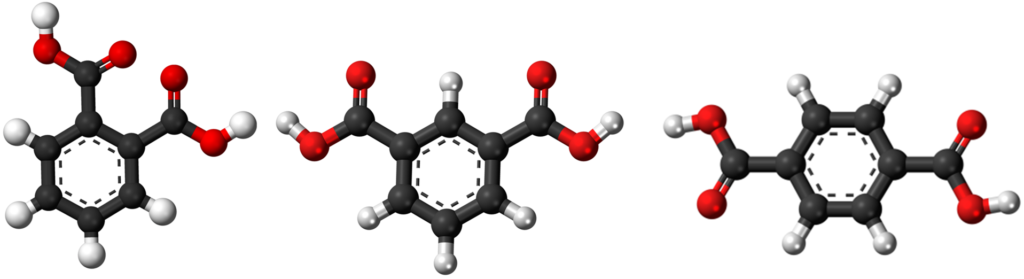
[Wikimedia Commons]
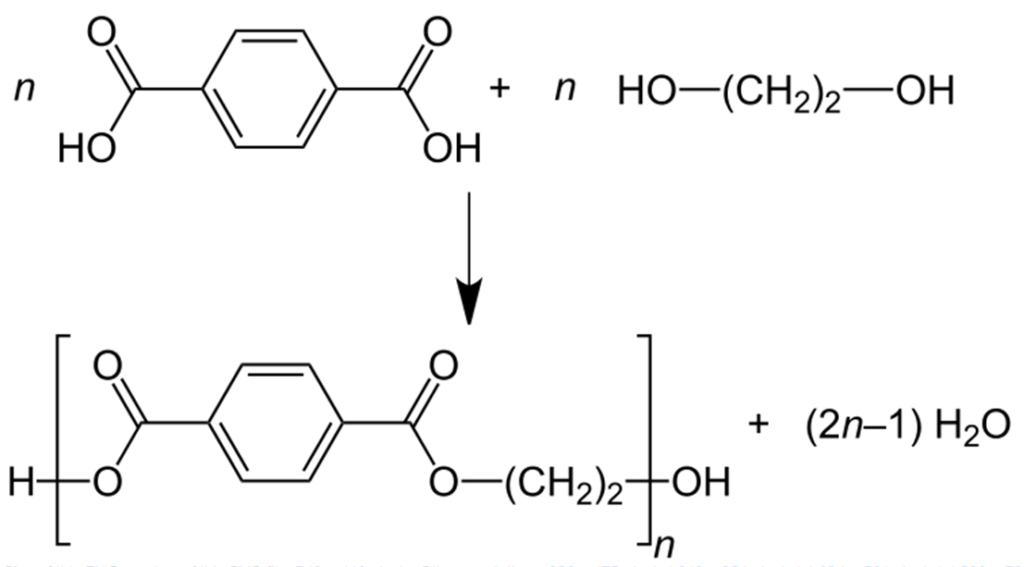
Synteza tych związków oparta jest głownie na utlenianiu odpowiedniego izomeru ksylenu, to znaczy pochodnej benzenu z dwoma grupami metylowymi (-CH3). Z kolei wykorzystanie tych związków to przede wszystkim przemysł tworzyw sztucznych. Obecność dwóch grup kwasowych stwarza możliwość tworzenia przez jedną cząsteczkę dwóch wiązań estrowych lub amidowych jednocześnie. Jeśli alkohol lub amina, z którymi utworzą grupę estrową/amidową, też ma co najmniej dwie grupy funkcyjne to jest to prosta droga do utworzenia długich łańcuchów polimerowych.
[Wikimedia Commons]
I tak kwas teraftalowy w reakcji z glikolem etylenowym tworzy poli(tereftalan etylenu), czyli w skrócie PET. To tworzywo, z którego wykonane są miliardy używanych przez nas butelek „plastikowych” do napojów, a także sztuczne włókna nie chłonące wody (jak np. w odzieży sportowej).
Do ciekawych związków dikarboksylowych nalezą także niektóre z ketokwasów (czyli kwasów z dodatkową grupą ketonową/karbonylową, czyli C=O). Spośród nich kwasy szczawiooctowy i kwas α-ketoglutarowy to istotne elementy cyklu oddechowego komórek zwanego cyklem Krebsa.
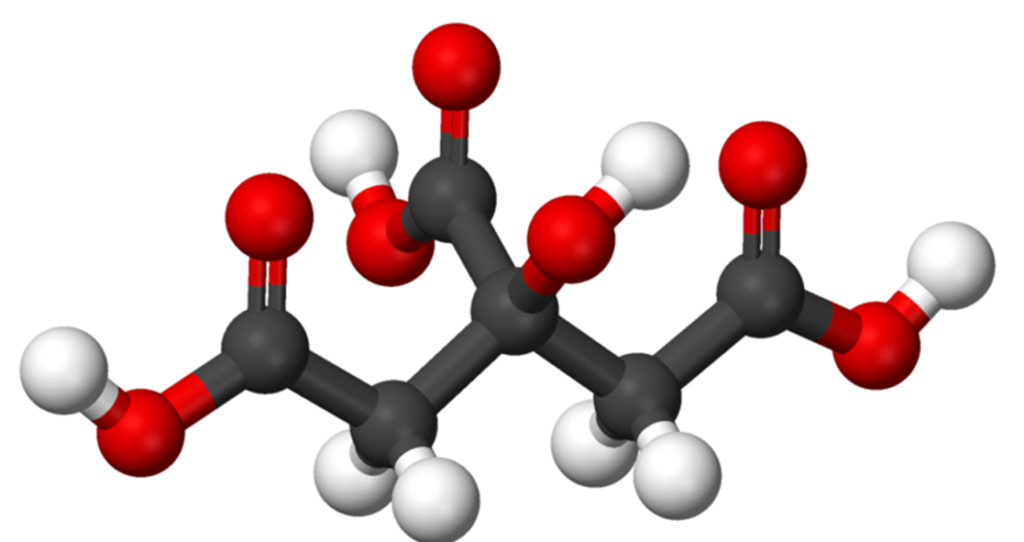
[Wikimedia Commons]
Zapytacie zapewne, czy istnieją także kwasy o jeszcze większej liczbie grup karboksylowych. Ależ oczywiście! I, co zapewne Was zdziwi, nie są one wcale taką rzadkością, jakby się mogło wydawać. Otóż przedstawicielem tej grupy związków jest jakże powszechny kwas cytrynowy, który ma nie tylko trzy grupy karboksylowe ale i jedną grupę hydroksylową. Przyznajcie, ze to całkiem sporo jak na związek o tylko sześciu atomach węgla w cząsteczce.
Oczywiście teoretycznie nic nie szkodzi na przeszkodzie, by tworzyć związki o jeszcze większej liczbie grup karboksylowych, jakkolwiek musi na nie starczyć miejsca w cząsteczce. Pozwolę sobie wspomnieć o dwóch przykładach kwasów tetrakarboksylowych, jak kwas 1,4-benzochinonotretrakarboksylowy czy kwas furanotetrakarboksylowy. Są one stosunkowo nietrwałe i mają znaczenie jedynie w pewnych specyficznych reakcjach syntezy organicznej.
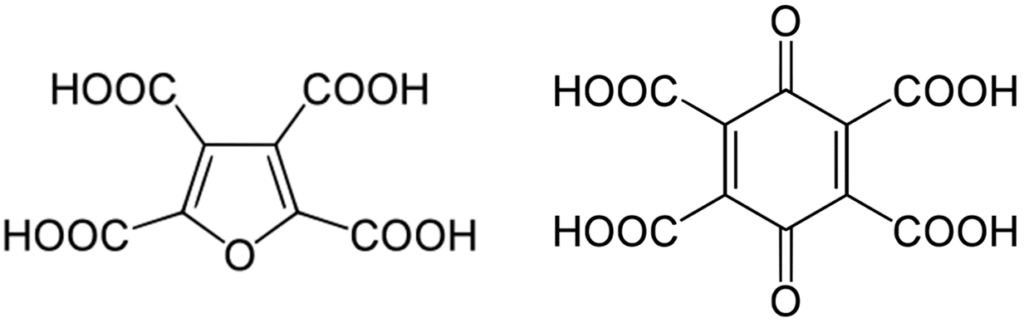
Na koniec jeszcze dodam, że istnieje także jon metanotetrakarboksylowy. Świadomie piszę „jon” a nie „kwas” ponieważ tylko jego forma jonowa jest wystarczająco stabilna, by móc ją badać i wykorzystać w różnych syntezach chemicznych.
A teraz pozwólcie, że już zakończę, choć chciałoby się napisac i o kwasach pentakarboksylowych, heksakarboksylowych, heptakarboksylowych, oktakarboksylowych itd. itd. itd…. 😉
Wojciech Smułek
19.07.2022
