W naszych chemicznych opowiastkach kilkakrotnie już pojawiło się pojęcie „izotopy”. Choć pewnie dla większości z Was temat nie jest całkiem obcy, poświęćmy mu dziś kilka chwil.
Atom każdego pierwiastka składa się z jądra atomowego i krążących wokół niego elektronów. Z kolei jądro atomowe zbudowane jest z protonów i neutronów. Właściwości chemiczne pierwiastka, a więc jego reaktywność, zdolność do tworzenia struktur krystalicznych itp., zależy przede wszystkim od ilości protonów a tym samym elektronów, ponieważ to one właśnie tworzą wiązania chemiczne. Dlatego też liczba atomowa, tzn. ilość protonów w jądrze, wyróżnia dany pierwiastek i pozwala przyporządkować mu odpowiednie „miejsce” w układzie okresowym.
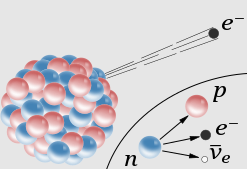
Dodajmy jeszcze, że jeśli w wyniku jakichś procesów fizycznych zmieni się ilość protonów, np. zostanie jeden z nich z tego jądra „wybity” albo „przyłączony”, to wówczas następuje przemiana jednego pierwiastka w drugi, np. litu w hel, czy azotu w tlen.
[Inductiveload, via Wikimedia Commons]
A co z neutronami? One z kolei mają kluczowe znaczenie dla stabilności jądra atomowego. Pomyślmy, skoro protony mają elektryczny ładunek dodatni i działają na nie siły odpychające to coś musi je trzymać ze sobą w tym jądrze. Tym czymś są siły atomowe, wynikające z różnego rodzaju oddziaływań między cząstkami elementarnymi, kwarkami, gluonami itp. Wybaczcie, ale w ten obszar nie będę wchodził. Rozumiecie, to taka niepisana umowa fizyków z chemikami. My im nie wchodzimy do atomów, za to oni pozwalają nam się nimi bawić i sklejać w różne cząsteczki.
A tak bardziej na poważnie, to rzecz wymagałaby dłuższej opowieści. Dla nas kluczowe jest teraz, że neutrony stabilizują jądro atomowe, przy czym praktycznie nie zmieniają właściwości chemicznych danego pierwiastka.
Konsekwencją tego jest fakt, że w jądrze danego pierwiastka liczba neutronów nie jest ściśle zdeterminowana. Żeby utrzymać jądro w całości, neutronów musi być mniej więcej tyle co protonów. To „mniej więcej” jest tu kluczowe. Jest pewna optymalna liczba neutronów scalających jądro, ale przy nieco większej lub mniejszej ilości neutronów atom też przetrwa, choć czas jego istnienia będzie ograniczony.
I tu przyda nam się pojęcie „izotopu”, czyli atomu o określonej liczbie protonów i neutronów. Z tą pierwszą liczbą jest ściśle powiązana nazwa pierwiastka, dlatego mówimy o izotopach węgla, izotopach uranu itd. Dla precyzji podaje się dodatkowo liczbę oznaczającą sumaryczną liczbę protonów i neutronów w jądrze danego pierwiastka i tak mamy np. fosfor-19 albo bar-138.
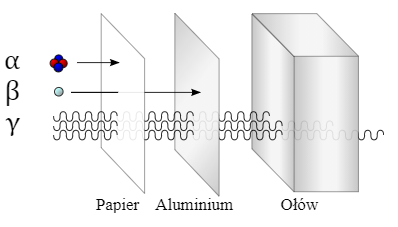
Wspomniałem chwilę temu, że niektóre jądra są trwałe, inne zaś mają określony czas istnienia (czasem się mówi „czas życia”). Te pierwsze nazywamy izotopami stabilnymi (trwałymi), te drugie niestabilnymi (nietrwałymi) albo promieniotwórczymi lub radioizotopami, ponieważ ich rozpad jest powiązany z emisją promieniowania jonizującego, alfa, beta lub gamma.
Izotopy dzieli się także na naturalne i sztuczne, a więc otrzymywane jedynie w warunkach laboratoryjnych. Choć wśród tych pierwszych wstępują zarówno izotopy stabilne, jak i te nietrwałe, to sztuczne izotopy to wyłącznie izotopy promieniotwórcze.
Ponieważ o izotopach słyszymy głównie w kontekście właśnie izotopów promieniotwórczych, należy powiedzieć nieco więcej o jednym z najistotniejszych parametrów je opisujących, czyli czasie ich trwania. Jest on, jak wspomniałem, ograniczony i wbrew pozorom trudny do jednoznacznego określenia. Jeśli jednak podejdziemy do sprawy statystycznie, to możemy wyznaczyć, kiedy ulegnie rozpadowi średnio połowa z obecnych w danej próbce atomów. Mowa tu o tzw. czasie połowicznego rozpadu. Nie znaczy on, jak to czasami piszą uczniowie i studenci, że atomy rozpadną się na połowy, ale że połowa atomów z danej porcji ulegnie rozpadowi. Czas ten jest bardzo różny, od miliardów lat (jak np. uran-238) po milisekundy (np. polon-214).
O czasie połowicznego rozpadu należy dodać, że jeśli czas rozpadu wynosi powiedzmy 3 lata, to po tych trzech latach rozpadnie się połowa atomów a po kolejnych trzech latach druga połowa i po sprawie. Nie, nie, Kochani, sprawa jest nieco bardziej złożona. Po kolejnych trzech latach ropadnie się połowa z tej połowy która pozostała, czyli jedna czwarta. Po kolejnych trzech latach rozpadnie się połowa z tej pozostałej jednej czwartej, czyli jedna ósma itd.
To trochę tak jak liczebność „czołówki” w biegach długodystansowych, tuż po starcie na czele biegną prawie wszyscy, potem na pierwszych kilometrach odpada najwięcej zawodników, a potem tempo „odpadania” maleje i skład „czołówki” pozostaje praktycznie niezmienny.
[Alfa_beta_gamma_radiation.svg: User:Stanneredderivative work: Ehamberg, via Wikimedia Commons]
Właściwości izotopów interesują przede wszystkim fizyków. Dla chemika, zasadniczo nie mają one znaczenia, choć podam dwa przypadki.
Pierwszym z nich jest kwestia masy atomowej pierwiastka. Gdyby każdy pierwiastek miał tylko jeden stabilny izotop to nie byłoby problemu, ale co w przypadku, jak np. chloru, jest w przyrodzie 75% izotopu o masie 35, a pozostałe 25% to izotop 37? Ponieważ nawet operując na miligramach danej substancji to i tak oznacza to, że pracujemy z miliardami miliardów atomów, to musimy odwołać się do statystyki i przyjąć, że w naszej próbce proporcje między izotopami są takie same jak w całej przyrodzie i do obliczeń chemicznych bierzemy masę uśrednioną (ale uwzględniającą liczebność poszczególnych izotopów). Dla chloru to będzie 35,5.
Drugą kwestią, choć bardziej subtelną, jest fakt, że izotopy cięższe nieco wolniej wchodzą w reakcje chemiczne, niż ich lżejsi kuzyni z atomowej rodzinki izotopów. Wynika to właśnie z ich większej masy, bo cięższe atomy poruszają się wolniej (jeśli mają taką samą energię co te lżejsze). To powoduje, że dłużej im zajmuje np. spotkanie innego pierwiastka, z którym są w stanie zareagować.
W praktyce to nie ma takiego dużego znaczenia. I tak wszystkie parametry reakcji chemicznych są zwykle wyznaczane eksperymentalnie, a więc same w sobie są uśrednione, jak opisana wyżej masa atomowa. Niemniej w przypadku wolnych reakcji i relatywnie dużych różnic mas między izotopami różnice szybkości reakcji mogą być już zauważalne. To sprawia, że można tym sposobem separować izotopy cięższe od lżejszych. Tym sposobem dość często separuje się wodór-1 od wodoru-2 (czyli deuteru). Ale o atomowej rodzince izotopów tego najlżejszego pierwiastka opowiem jeszcze za tydzień, a tymczasem dziękuję za uwagę;)
Wojciech Smułek
