Ostatnio skończyliśmy bardzo kolorowo i apetycznie tematem żeli, jakie spotykamy w naszych jadłospisach, a mianowicie kwestią galaretek. Dzisiaj chciałbym trochę opowiedzieć o innych, nie-kuchennych, żelach, ale najpierw musimy sobie wyjaśnić kilka spraw.
Po pierwsze musimy odpowiedzieć na pytanie, jakie substancje mogą tworzyć żele. Aby one mogły powstać potrzebne są co najmniej dwa związki chemiczne, tworzące dwie odrębne (choć gołym okiem nierozróżnialne) fazy. Jedna z nich to zwykle woda lub inna ciecz utworzona przez związki organiczne, np. jakiś alkohol.
Drugim składnikiem jest związek chemiczny, który powinien posiadać dwie ważne właściwości. Po pierwsze zdolność tworzenia usieciowanej struktury (w wyniku opisanej ostatnio przemiany zolu w żel), a po drugie być w stanie zatrzymać w strukturze żelu tę pierwszą z wymienionych wcześniej substancji (np. wodę) w strukturze żelu. W pewnym sensie chodzi o to, żeby ta ciecz nie „wypłynęła” z tej sieci utworzonej przez tą drugą substancję.
[Y tambe, via Wikimedia Commons]
W roli tego czynnika sieciującego bardzo dobrze czują się polimery, zarówno te naturalne jak i syntetyczne. Długie łańcuchy polimerów, których atomy są powiązane wiązaniami kowalencyjnymi stanowią solidne „rusztowanie” dla żelu. Pamiętajmy jednak, że zwykle w obrębie żelu nie występuje jedna gigantyczna cząsteczka polimeru, nawet jeżeli liczy ona tysiące atomów w swej strukturze. Musi więc istnieć jakiś łącznik między cząsteczkami polimeru, aby uniemożliwił on przemieszczanie się ich względem siebie.
Niekiedy same siły przyciągania między cząsteczkami (elektrostatyczne lub tzw. siły van der Waalsa) wystarczą, by utrzymać sieć żelu. Czasem jednak konieczne jest dodanie innego związku chemicznego, choćby jonów metali (np. dwuwartościowych Ca2+), które tworzą wiązania jonowe z dwoma cząsteczkami polimeru jednocześnie.
Aby spełnione było drugie wymaganie, to znaczy zdolność utrzymania cząsteczek cieczy w żelu, substancja sieciująca musi zawierać wolne grupy funkcyjne, które będą tworzyć wiązania ze wspomnianymi cząsteczkami cieczy. W przypadku żeli zawierających wodę szczególnie preferowane są grupy funkcyjne tworzące wiązania wodorowe, np. grupy hydroksylowe (-OH), karboksylowe (-COOH) albo aminowe (-NH2). Tego typu wiązania tworzą bardzo silne oddziaływania z cząsteczkami wody skutecznie utrzymując ją w strukturze żelu.
[NEUROtiker, Public domain, via Wikimedia Commons]
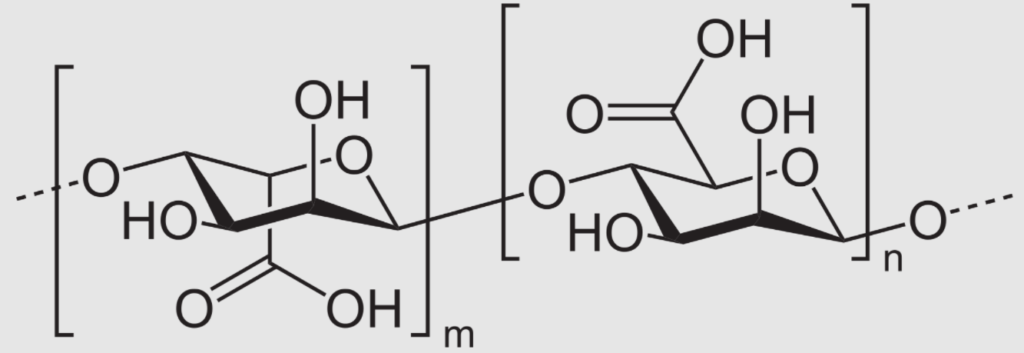
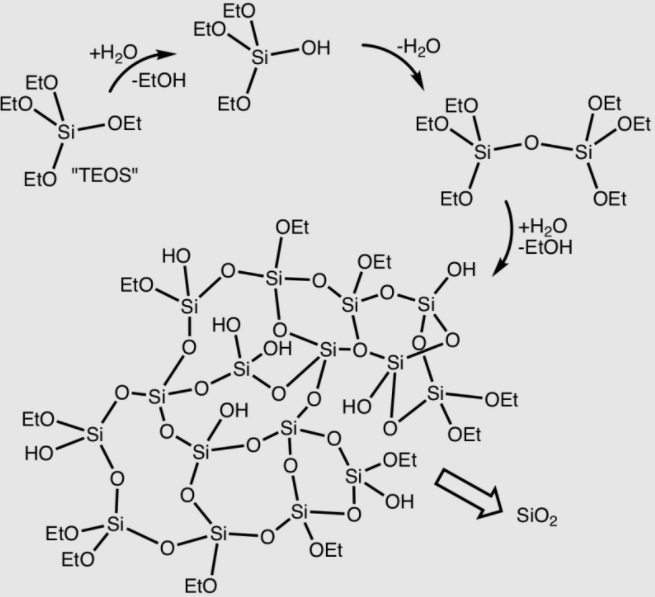
Najbardziej popularnymi są żele oparte właśnie na wodzie, która jest tanim i nietoksycznym rozpuszczalnikiem. Tego typu materiały nazywamy zbiorczo hydrożelami. Jako substancje żelujące stosuje się związki naturalne będące białkami (jak choćby żelatyna) albo polisacharydami (np. agar). Do tej ostatniej grupy należą także alginiany, ale wymagają one stosowania dodatku sieciującego, którym są jony wapniowe(II) lub magnezowe(II). Hydrożele tworzy się także w oparciu o polimery syntetyczne, jak np. PVP (poli(winylopirolidon)) lub PEG (poli(glikoletylenowy)). Są również znane żele oparte o związki nieorganiczne, zwłaszcza krzemu (są to tzw. silikażele).
[Smokefoot, Public domain, via Wikimedia Commons]
Żele są zwykle substancjami sprężystymi i elastycznymi. Dodatkowo z racji dużej zawartości wody, hydrożele są materiałami stosunkowo tanimi, choć ich cena zależy oczywiście od kosztów substancji sieciującej. Struktura żeli sprawia, że dyfuzja (migracja cząsteczek innych związków chemicznych) odbywa się w nich dużo łatwiej niż w przypadku innych ciał stałych.
Te cechy sprawiają, że żele znajdują wiele zastosowań w medycynie. Żelowe kapsułki z lekami, żelowe okłady na rany czy żelowe implanty chrząstek (np. ucha) to tylko te najbardziej znane przykłady. Żele są też wykorzystywane w inżynierii jako materiał tłumiący drgania.
Inną ciekawą cechą hydrożeli jest fakt, że pozbawione wody (np. przez wysuszenie) stają się wysoce higroskopijne, a więc zdolne do pochłaniania wody w stanie ciekłym a w szczególności pary wodnej z powietrza. Stąd też wzięły się małe torebeczki silikażelu jakie znajdujemy w opakowaniach ze sprzętem elektronicznym albo… butami. Co więcej, tzw. polimery superabsorpcyjne (SAP) zdolne do wielokrotnego zwiększania swojej masy chłonąc wodę, znajdują zastosowania np. w pieluszkach jednorazowych!
Usunięcie z żelu rozpuszczalnika (wody lub związku organicznego), zachowując jednocześnie jego usieciowaną strukturę, pozwala otrzymać aerożel. Jest to materiał bardzo lekki, ponieważ jest on wysoce porowaty, co oznacza, że dziewięćdziesiąt kilka procent jego objętości zajmuje gaz (np. powietrze) lub, w specyficznych wypadkach, próżnia.

[Courtesy NASA/JPL-Caltech, Public domain, via Wikimedia Commons]
Specjalne aerożele o niezwykle stabilnej strukturze sieci stanowią cenne materiały konstrukcyjne, zarówno lekkie jak i wytrzymałe. Ponadto są one w stanie wyłapywać wiele bardzo niewielkich cząstek stałych, co wykorzystano m.in. w konstrukcji sondy kosmicznej Stardust (z ang. „Kosmiczny pył”), której celem było pozyskanie próbek materiału wydobywającego się z jądra komety Wild 2. Użyty jako „pułapka” aerożel miał gęstość wynoszącą 3 mg/ml, czyli ponad 300 razy mniejszą od wody.
Gdy wiec rozejrzycie się wokół siebie być może dostrzeżecie więcej interesujących żeli, które, jak się okazuje, możemy spotkać nie tylko jako element naszych posiłków 😉.
Wojciech Smułek
27.02.2022
