W powszechnym mniemaniu podział na chemię organiczną i nieorganiczną jest dość ścisły (w końcu chemia to nauka ścisła, czyż nie?). Wiemy, że chemia organiczna zajmuje się związkami węgla, przy czym mogą one zawierać także atomy wodoru, tlenu, siarki i azotu, a czasem chloru lub innych halogenów. Z pewnością jednak nikt nie będzie kojarzył chemii organicznej z metalami. Może co najwyżej z katalizatorami, takimi jak platyna, które są w chemii organicznej szeroko stosowane.
A jednak rzeczywistość jest dużo bardziej skomplikowana. Jest całkiem spora rodzina związków nazywanych metaloorganicznymi, a więc takimi, w których organicznej (czyli zasadniczo węglowodorowej) strukturze znajdują się także atomy metali, jak na przykład ołowiu. Jakkolwiek niejako awansem do związków metaloorganicznych zalicza się także związki organiczne półmetali i niemetali o niskiej elektroujemności (czyli takich z 13 i 14 grupy układu okresowego), w tym boru, krzemu lub arsenu.
Nim bliżej poznamy związki metaloorganiczne, należy poczynić ważne zastrzeżenie. Otóż pod tą nazwą występują tylko te związki, w których występuje bezpośrednie wiązanie węgiel-metal (lub wymienione pół- i niemetale), np. C-Pb czy C-Pt. Do związków metaloorganicznych nie zalicza się natomiast związków, w których metale łączą się z łańcuchem węglowym poprzez tlen czy azot, czyli nie są nimi np. sole kwasów karboksylowych.
Związki metaloorganiczne nie należą do szczególnie popularnych w przyrodzie. Metale tworzą wprawdzie wiele użytecznych dla komórek żywych kompleksów (np. stając się elementem budowy enzymów), ale zwykle nie są to związki spełniające wspomnianą definicję związków metaloorganicznych. Spośród obecnych w organizmie człowieka cząsteczek, związkiem metaloorganicznym w ścisłym tego słowa znaczeniu jest zasadniczo tylko witamina B12, zawierająca atom kobaltu (i dlatego jest ona nazywana kobalaminą).
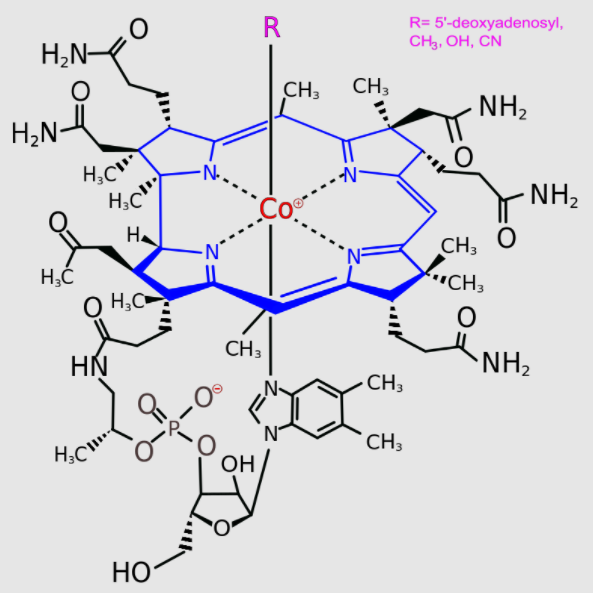
[RicHard-59, Public domain, via Wikimedia Commons]
Współcześni chemicy organicy stosują jednak w swoich laboratoriach bardzo dużo związków metaloorganicznych. Zwykle stanowią one produkty pośrednie w procesach syntezy bardzo złożonych cząsteczek, ale jest kilka związków metaloorganicznych, które były lub są produkowane na skalę masową.
Do takich związków należał niesławny tetraetyloołów (Pb(C2H5)4), który był stosowany jako dodatek do paliw, polepszający ich właściwości i zapewniający korzystniejsze warunki pracy silników spalinowych. Stosowanie tetraetyloołowiu skutkowało jednak ulatnianiem się ołowiu wraz spalinami i zatruwaniem środowiska, szczególnie w sąsiedztwie dróg. Na szczęście obecnie inne dodatki, jak eter metylo-tertbutylowy (MTBE), wyparły z użycia ów toksyczny związek.

[Jynto, CC0, via Wikimedia Commons]
Innymi toksynami metaloorganicznymi są związki rtęci: metylortęć (HgCH3) i dimetylortęć (Hg(CH3)2). To bardzo silna trucizna, wielokrotnie bardziej niebezpieczna od czystej rtęci, ponieważ jest o wiele łatwiej przyswajalna przez organizmy żywe. Niegdyś wykorzystywane w produkcji pestycydów, dziś są już skutecznie wyrugowane z przemysłu. Przyczyniło się do tego szereg wypadków śmiertelnych z udziałem tych związków, a najgłośniejszym była historia zatrucia kilku tysięcy osób z rejonu zatoki Minamata w Japonii w latach 50. XX w.
Ale są również związki metaloorganiczne dużo bezpieczniejsze a przy tym niezwykle użyteczne. Należą do nich związki magnezoorganiczne zwane związkami Grignarda, od nazwiska ich odkrywcy. Kiedy w roztworze eteru dietylowego zmieszamy metaliczny magnez ze związkiem halogenoorganicznym to nastąpi szereg następujących reakcji (gdzie X oznacza halogen, np. Br; a R – łańcuch węglowodorowy lub pierścień aromatyczny):
R−X + Mg → R−X•− + Mg•+
R−X•− → R• + X−
R• + Mg•+ → RMg+
RMg+ + X− → RMgX
Proces jest z początku powolny, ale potem reakcja gwałtownie przyspiesza, czemu towarzyszy intensywna emisja ciepła, bowiem proces jest silnie egzotermiczny. To sprawia wiele problemów przy wielkoskalowej, przemysłowej produkcji tych związków, ponieważ używane w tym celu reaktory muszą mieć wysokowydajny system chłodzenia. No dobrze, ale spytacie może, w jakim celu produkuje się te związki, tym bardziej, że jak wspomniałem, wytwarza się je na masową skalę, a to oznacza, że nie jest to tylko naukowa ciekawostka.
Związki Grignarda są niesamowicie użytecznym narzędziem, pozwalającym uzyskać szeroką gamę związków. Wiązanie węgiel-magnez jest bardzo reaktywne. Szczególnie chętnie reaguje z grupą karbonylową. Dzięki związkom magnezoorganicznym możliwe jest więc tworzenie nowych wiązań węgiel-węgiel i tym samym syntezę nowych, bardziej złożonych związków z dwóch mniejszych cząsteczek. Powstały w wyniku tej syntezy związek z grupą -O-MgX poddaje się potem działaniu wody, co daje w rezultacie alkohol i halogenek magnezu.
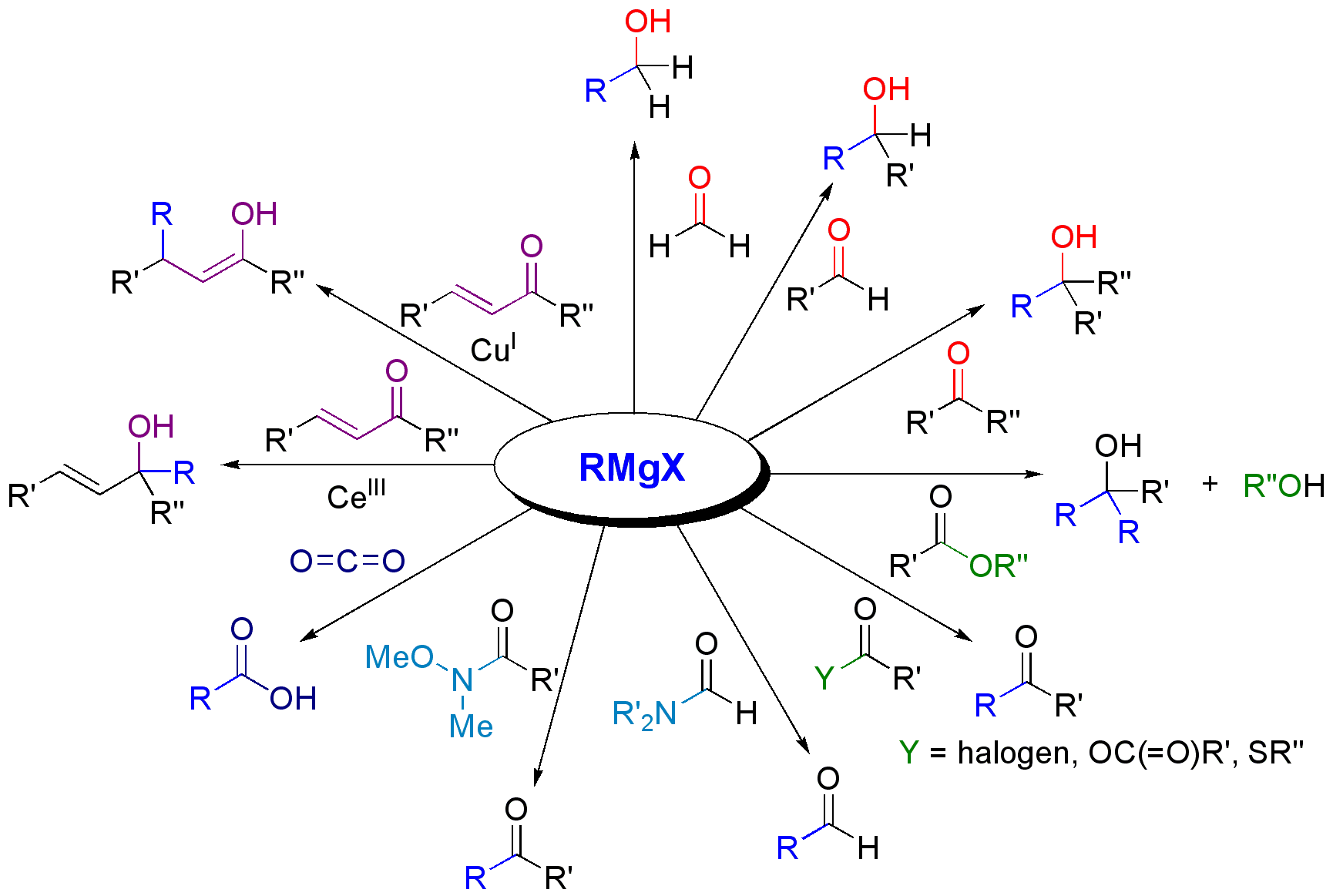
[Calvero., Public domain, via Wikimedia Commons]
Ciekawą właściwością związków Grignarda jest ich reakcja z dwutlenkiem węgla prowadzącą do podmienienia grupy -MgX grupą -COOH, czyli w rezultacie powstaje kwas karboksylowy. Inną cechą związków Grignarda jest ich łatwość we wchodzeniu w reakcję z alkoholami, wodą i innymi związkami z aktywnym wodorem (to znaczy takim, który względnie łatwo odrywa się od cząsteczki w formie protonu). Stąd też podczas syntezy związków magnezoorganicznych należy bezwzględnie unikać nawet najmniejszych ilości wody lub alkoholu.

[Calvero., Public domain, via Wikimedia Commons]
Te wspomniane przeze mnie przykłady oczywiście nie wyczerpują listy ciekawych związków metaloorganicznych. Jest ich znacznie, znacznie więcej. A więc gdy zobaczycie chemika organika, jak biegnie z kolbami pełnymi metalicznych wiórków nie myślcie, że zmienił branżę. Może po prostu pracuje nad jakąś kolejną ciekawą syntezą…
Wojciech Smułek
23.01.2022 r.
