Nie raz już Wam pokazałem, że wszystko może stać się przyczynkiem do chemicznych rozważań i skojarzeń. Spacer wśród ogródków działkowych również. Tajemnicze czynności związane z wsypywaniem białego proszku do kretowiska, nie mogły zostać przeze mnie nie zauważone. Chwila rozmowy z dokonującym owego rytuału i już było wiadomo, w czym rzecz.
Karbid, bo o nim mowa, to znany od lat środek skutecznie odstraszający krety, ale także inne drobne gryzonie. Podkreślam „odstraszający”, ponieważ związek ten nie jest zasadniczo trujący dla istot żywych i jest nietrwały w przyrodzie, ale właśnie jego rozkład (w wyniku reakcji z wodą) powoduje powstanie oparów drażniących powonienie wspomnianych zwierzątek. Mimo to warto pamiętać, że karbid działa drażniąco na skórę a już absolutnie trzeba unikać jego kontaktu z oczami.
[Ondřej Mangl, Public domain, via Wikimedia Commons]
Wszystko stanie się dla nas bardziej zrozumiałe, kiedy pojmiemy, czym tak naprawdę jest karbid. Jego dawna chemiczna nazwa to węglik wapnia i jest to związek o jakże prostym wzorze CaC2. Mimo obecności węgla w cząsteczce nie jest to związek organiczny. Jakkolwiek pewne pokrewieństwo jest, ponieważ badania struktury cząsteczki karbidu pokazały na szczególną relację między obecnymi w nim atomami węgla. Są one bowiem połączone potrójnym wiązaniem, identycznym jak w strukturze etynu, czyli acetylenu.
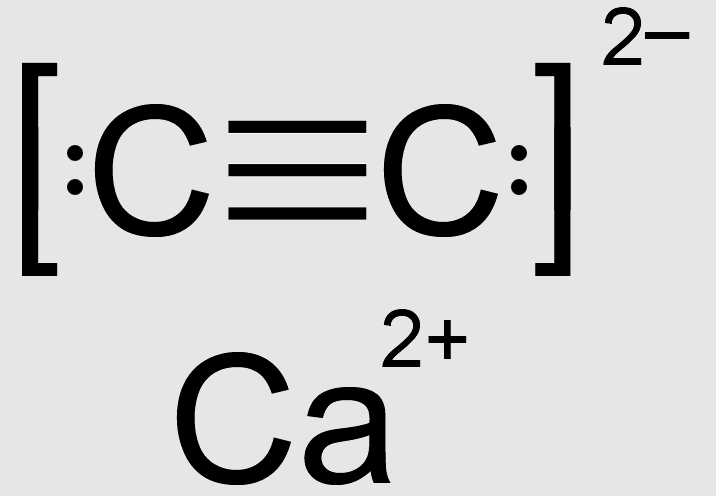
[Hellbus – Praca własna, via Wikimedia Commons]
Ta charakterystyczna struktura powoduje, że węglik wapnia jest obecnie nazywany acetylenkiem wapnia. Ponadto wyjaśnia to wysoką reaktywność karbidu, który w reakcji z wodą tworzy właśnie acetylen (a produktem ubocznym jest wodorotlenek wapnia):
CaC2 + 2H2O → Ca(OH)2 + C2H2 ↑
Łatwość, z jaką z karbidu można wyprodukować palny gaz – acetylen, była przyczyną jego niezwykłej popularności w XIX i pierwszej połowie XX w. jako paliwa w przenośnych lampkach, tak zwanych karbidówkach (karbidkach). Lampy te, choć bardzo różnorodne w formach, zasadniczo składały się z dwóch zbiorniczków, górnego z wodą i dolnego z karbidem. Kapiąca na acetylenek wapnia woda powodowała powstawanie acetylenu, który przez wąską rurkę był kierowany na zewnątrz, gdzie zapalony dawał jasny, stabilny płomień.
Pomysłowa konstrukcja lampy powodowała, że zamknięcie zaworu na rurce z gazem powodowało zatrzymanie gazu wewnątrz pojemnika z karbidem, a wzrastające w nim ciśnienie uniemożliwiało spływanie wody z górnego zbiorniczka. W ten sposób reakcja ustawała samoczynnie i nie było ryzyka rozsadzenia lampy przez powstający acetylen. Genialne, prawda?

[Megan Kirkeby, via Wikimedia Commons]
Nim wynaleziono i upowszechniono elektryczne lampki na baterie, karbidówki pełniły funkcję dzisiejszych latarek, a także były stosowane jako oświetlenie w rowerach czy samochodach. Jednak po dziś dzień tego typu lampki kojarzą się przede wszystkim z górnictwem, jako swego rodzaju atrybut górnika, podobnie jak kask czy kilof.
Reakcja karbidu z wodą jest silnie egzotermiczna, czyli oprócz produkcji acetylenu towarzyszy jej wydzielanie bardzo dużych ilości energii w postaci ciepła. To jedna z przyczyn dlaczego karbid działa drażniąco na skórę czy błony śluzowe, które w końcu zawierają całkiem sporo wody. Ponadto karbid chłonąc wodę działa także bardzo wysuszająco.
Wróćmy jednak do chemicznych kwestii. Rozkład karbidu (jego hydroliza) jest jak pisałem ezgotermiczny, a z kolei jego otrzymywanie jest niezwykle endotermiczne. Reakcja otrzymywania karbidu to reakcja wapnia palonego (tlenku wapnia) z koksem (czyli niemal czystym chemicznie węglem):
3C + CaO → CaC2 + CO↑
Ten proces wymaga temperatur rzędu 2000-2200ºC. Uzyskanie tak wysokiej temperatury wymagało często stosowanie pieców z łukiem elektrycznym, to znaczy ciągłym wyładowaniem elektrycznym, na podobieństwo sztucznego pioruna. Taki proces był, jak łatwo się domyślić, niezwykle energochłonny, a więc produkcję karbidu prowadzono często w sąsiedztwie dużych elektrowni, na przykład tej przy słynnym wodospadzie Niagara.

[© Paweł Marynowski / Wikimedia Commons]
No dobrze, ale pewnie co niektórym pojawiła się w głowie następująca wątpliwość. A dlaczego karbid tak (nie bójmy się tego słowa) śmierdzi, skoro acetylen jest praktycznie bezwonny, jak nas uczono na lekcjach chemii. Potwierdzić to mogą także ci, którzy zetknęli się z acetylenem, jako gazem stosowanym przy spawaniu metali.
To wszystko prawda. Rzecz w tym, że karbid, jaki stosowano niegdyś w lampach a obecnie jest środkiem na krety, nie jest czystym chemicznie acetylenkiem wapnia, ale zawiera domieszkę pewnych zanieczyszczeń powstałych we wspomnianej reakcji wapnia palonego z koksem. Jedną z tych domieszek jest fosforek wapnia, Ca3P2. Reaguje on z wodą tworząc fosforowodór i to właśnie on, choć w znikomych ilościach odpowiada za ten paskudny zapach karbidu. Ot cała tajemnica.
Wspomniane zastosowania karbidu nie wyczerpują możliwości jego wykorzystania. Bywa on stosowany w hutnictwie i produkcji nawozów sztucznych. Co niektórzy zetknęli się także z wykorzystaniem karbidu do specyficznych form zabawy, a mianowicie produkcji swego rodzaju petard. Ale chyba nie muszę mówić, że nie należy to do bezpiecznych sposobów spędzania wolnego czasu. To już lepiej rozejrzyjcie się po sklepach i straganach ze starociami. Może wypatrzycie tam jakąś karbidówkę. Weźcie ją wtedy do ręki. Nie będzie to może lampa Aladyna z wszechmogącym dżinem, ale z pewnością poczujecie ostry zapach, który przypomni Wam tą chemiczną opowieść…
Wojciech Smułek
