Tytuł tekstu nawiązuje oczywiście do zabawnej komedii sprzed równo 40 lat z Eddie’m Murphym i Danem Aykroydem w rolach głównych, ale dziś nie o grze na giełdzie (tak istotnej dla fabuły filmu) chciałbym opowiedzieć. To po prostu było moje pierwsze skojarzenie, gdy pomyślałem, by napisać o reakcjach substytucji.
Gdybyśmy mieli poszukać polskiego odpowiednika pochodzącego z łaciny słowa „substytucja” to najlepsze byłoby „podmiana” lub „zamiana”. I rzeczywiście o to właśnie chodzi w reakcjach substytucji, o zamianę atomu lub grupy atomów w cząsteczce na inne. To co w teorii proste, staje się wyzwaniem, aby przeprowadzić to w ramach procesu chemicznego. Pamiętajmy, że taka reakcja musi się wiązać z rozerwaniem i jednocześnie utworzeniem co najmniej jednego wiązania chemicznego. Mechanizmów reakcji substytucji jest wiele, my zaś skupmy się na dwóch podstawowych typach, które najczęściej wykorzystywanych w chemii organicznej, to znaczy substytucji nuklofilowej i substytucji elektrofilowej.
Zacznijmy od wyjaśnienia terminów „elektrofil” i „nukleofil”, które odnoszą się do atomów, grup atomów i cząsteczek. Oznaczają one czy dana cząsteczka ma względny deficyt (niedomiar) elektronów (w przypadku elektrofila) lub ich nadmiar (u nukleofila). Inaczej mówiąc elektrofil może by akceptorem elektronów a nukleofil ich donorem. Potwierdza się więc stare chemiczne porzekadło, że jak nie wiadomo o co chodzi to pewnie chodzi o elektrony.

Przykłady elektrofilii i nukleofilii [https://cheminfo.uz/elektrofil-va-nukleofil-ortasidagi-farq/]
Typowymi elektrofilami są m.in. kationy jak H+, K+, ale też cząsteczki AlCl3. Z kolei do nukleofilów należą na przykład jony ujemne, jak OH– czy F–, ale również cząsteczki benzenu czy amoniaku (gdzie azot ma wolną grupę elektonową). Dodajmy jeszcze, że według teorii kwasów i zasad Lewisa (tak „ukochanej” przez maturzystów z chemii), elektrofile są kwasami a nukleofile zasadami.
Wróćmy więc teraz do substytucji elektrofilowej i nukleofilowej. Otóż różnica między nimi polega na tym, czy czynnik, który ma podmienić obecną już w cząsteczce grupę (czyli jak mówią chemicy „atakuje” cząsteczkę), jest elektrofilem czy nukleofilem. Przykładami reakcji substytucji elektrofilowych (oznaczanych jako SE) są reakcje halogenowania i nitrowania, a do substytucji nukleofilowej (w skrócie SN) należą rekcje estryfikacji czy kondensacji aldolowej.
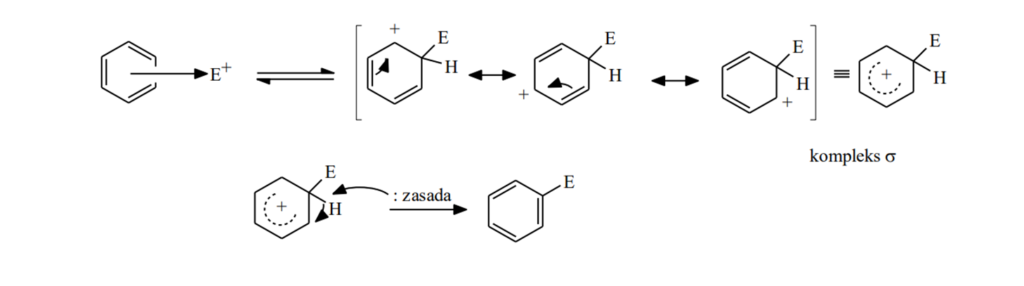
Reakcja substytucji elektrofilowej w układach aromatycznych zachodzi z wymianą atomu wodoru na reagent elektrofilowy
Chemicy rozróżniają także czy substytucja nukleofilowa jest jedno- czy dwucząsteczkowa, przy czym rozróżnienie wynika z tego, czy szybkość reakcji jest ograniczona przez stężenie tylko jednej z biorących w reakcji cząsteczek, czy stężeniem obydwu. Oba typy substytucji oznaczane są odpowiednio jako SN1 i SN2.
Należy pamiętać, że nie każdą grupę atomów czy atom w cząsteczce można zastąpić dowolnym innym. Kluczowa jest w tym wypadku siła wiązania między cząsteczką a zastępowaną lub nową grupą atomów. Zasadniczo atom lub grupa atomów zdolna do tworzenia silniejszego wiązania może zastąpić grupę/atom słabiej związaną z daną cząsteczką. Bezpośrednia wymiana w przeciwnym kierunku nie jest właściwe możliwa. Stąd w literaturze naukowej opisuje się szeregi grup atomów, które mogą się zastępować. To coś w rodzaju szeregu elektrochemicznego pierwiastków, który pokazuje, który metal wypiera jony innego metalu z roztworów.
Reakcje substytucji są kluczowe dla zrozumienia i planowania reakcji chemii organicznej. Stąd tak szeroko są omawiane na studiach chemicznych. I choć reakcje substytucji spędzają sen z powiek wielu studentkom i studentom to satysfakcja z opanowania tego zagadnienia jest potem przeogromna.
Wojciech Smułek
05.11.2023
