Mrozy nadeszły, że ho, ho. A przynajmniej takie ho, ho, patrząc z perspektywy kilku ostatnich lat. A mrozy to jeszcze nic, napadało śniegu, a ten, ubity potem setkami nóg, albo regularnie podtapiany i zmrażany zamienił nasze drogi i chodniki w lodowe ślizgawki.
Strategii walki z nimi jest kilka. Albo rozkuć lód i go odgarnąć, albo posypać piaskiem. Pierwsza opcja jest czaso- i praco-chłonna, ta druga ma ograniczoną skuteczność, ponieważ działa tylko przez pewien czas, potem piasek wtopi się w lód, wyślizga i tyle z jego dobroczynnych właściwości. I tu dochodzimy do sposobu trzeciego, a mianowicie „posolenia” dróg i chodników.
Chlorek sodu w akcji
W potocznym języku, mówi się o tym, że „sól rozpuszcza lód”. Chemicy lub fizycy naturalnie się obruszą, bowiem to zjawisko, z którym tu mamy do czynienia, rozpuszczaniem na pewno nie jest. Inni mówią „sól topi lód”, co jest bliższe prawdzie, ale też nią do końca nie jest.
Zejdźmy więc na poziom mikroskopowy, a nawet bardziej, na poziom cząsteczkowy. Sól kuchenna, chlorek sodu, ma budowę krystaliczną, a jego strukturę tworzą jony sodu i chloru, które tworzą stabilną sieć. Lód też ma strukturę krystaliczną, tyle, że utworzoną przez cząsteczki wody. Kiedy kryształek soli padnie na powierzchnię lodu jony sodu i chloru zaczynają oddziaływać z cząsteczkami wody.
Te jony, ze względu na swój niewielki rozmiar i obecność ładunku elektrycznego, silniej oddziałują z cząsteczkami wody, niż cząsteczki wody między sobą. W konsekwencji można powiedzieć, że cząsteczki wody są „wyrywane” ze struktury krystalicznej lodu, przy czym jeden jon sodu/chloru może oddziaływać z kilkoma cząsteczkami wody jednocześnie.
[Prolineserver, via Wikimedia Commons]
Mieszanina oziębiająca
Ponieważ opisane zjawisko jest samorzutne, a jednocześnie pochłania energię z otoczenia to mieszanina lodu z solą stanowi jedną z tzw. mieszanin oziębiających. Są one stosowane w laboratoriach do obniżania temperatury na niewielką skalę w sytuacjach, kiedy nie możemy skorzystać z zamrażarki. Zresztą sami zróbcie taki eksperyment w domu, kilka kostek lodu (najlepiej pokruszonych) albo porcję śniegu posypcie solą i włóżcie termometr, temperatura z pewnością wyniesie kilkanaście stopni poniżej zera.
Jakie są jednak konsekwencje omawianego zjawiska? Otóż, proces „wyrywania” cząsteczek wody prowadzi do tego, że rośnie ich ruchliwość i dochodzi do zmiany stanu skupienia ze stałego na ciekły. Lód znika i mamy więc roztwór soli w wodzie. Przy czym trzeba pamiętać, że przy odpowiednio niskiej temperaturze cząsteczki i jony obecne w roztworze soli w wodzie zmniejszą swoją energię i zwolnią na tyle, że też utworzą ciało stałe, no powiedzmy taki „słony lód”.
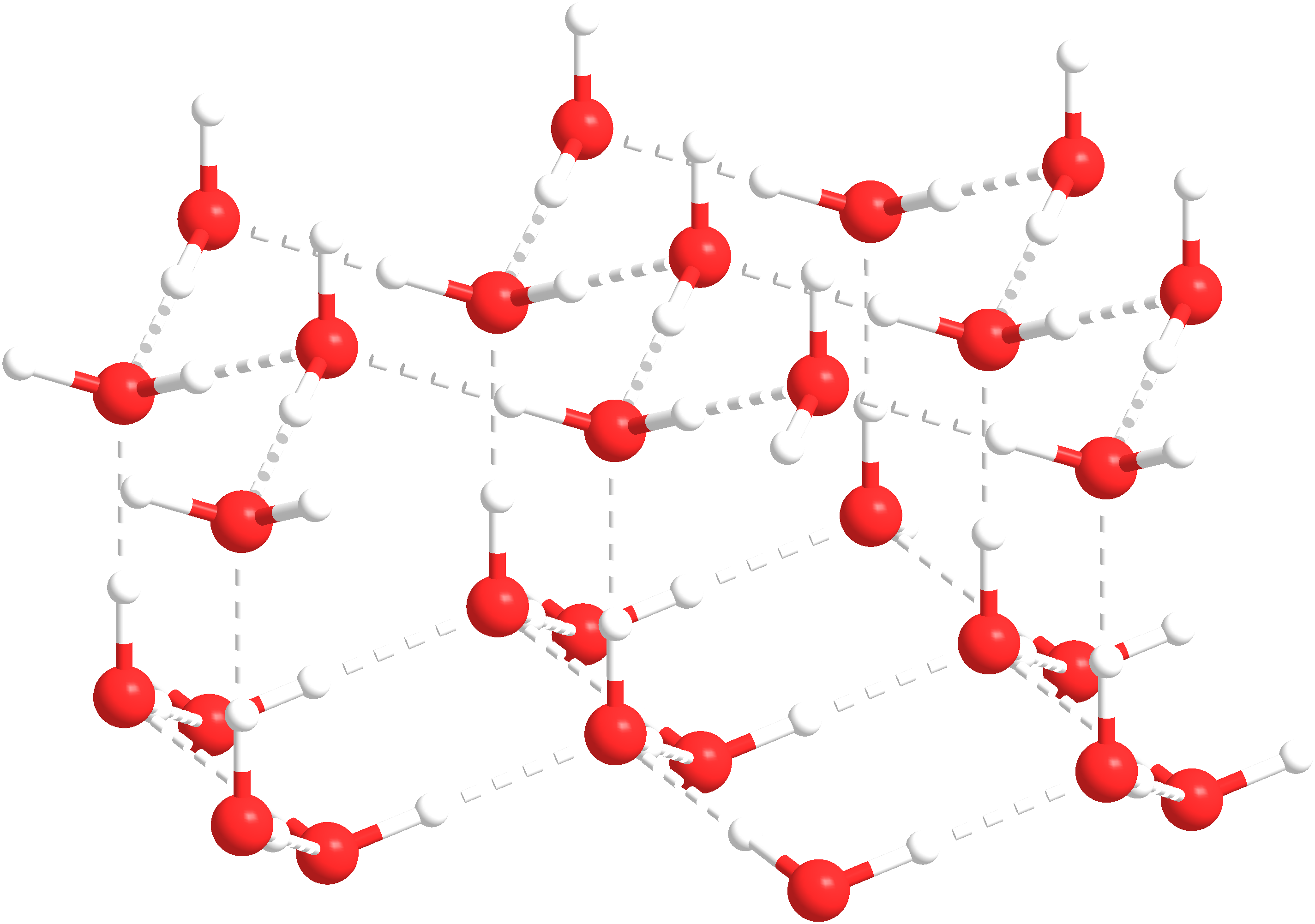
[Adam001d, via Wikimedia Commons]
A może „pocukrzyć”?
Zapyta ktoś, czy tylko w przypadku soli obserwujemy takie zjawisko. Otóż nie, wiele substancji rozpuszczalnych w wodzie działa podobnie, także inne sole, np. chlorek wapnia czy magnezu. Podobnie działają alkohole, np. etylowy, a także… cukier. Zamiast solić ulice można by je też posłodzić. Oczywiście wszystko rozbija się o koszty.
Warto tu nadmienić, że każda taka mieszanina wody z substancją rozpuszczoną ma inną temperaturę krzepnięcia (zamarzania), dla chlorku sodu to ponad -20oC a dla chlorku wapnia -40oC. Czyli na Syberii ta metoda raczej się nie sprawdzi;)
Kontrowersje i ciekawostki
Od czasu do czasu podnoszą się głosy, że nie jest to najlepszy sposób walczenia z zalodzonymi nawierzchniami. Rzecz w tym, że sól nie jest korzystna ani dla roślin, do których korzeni spływa rozpuszczony lód z solą, ani dla samochodów, które poddane działaniu słonej wody rdzewieją aż miło, ani dla naszych butów, które pokrywają się białym nalotem soli. Nie jest więc to sprawa jednoznaczna, metoda jest dość wygodna, ale w ogólnym rozrachunku nie obywa się bez strat…
Na koniec jeszcze jedna uwaga – obecność soli zmienia nie tylko temperaturę topnienia, ale i temperaturę wrzenia. Stąd woda z solą wrze w temperaturze o kilka stopni wyższej niż czysta woda. W tym wypadku mówimy, że mamy do czynienia z tzw. efektem ebulioskopowym. To tak przy okazji podrzucam trudne słówko do zapamiętania. Kto wie może się przyda przy rozwiązywaniu krzyżówki albo podczas udziału w jakimś teleturnieju. Tam lubią takie ciekawostki 😉
