„Serve and protect”. Bywalcy w Stanach Zjednoczonych, a także widzowie amerykańskich filmów (do których zalicza się autor) być może widzieli na radiowozach tamtejszej policji to motto, które właśnie można przetłumaczyć „Służyć i chronić”. Nie będziemy dzisiaj oczywiście pisać o policji, ale jakoś tak mi się to hasło skojarzyło, kiedy zabierałem się za pisanie o powłokach ochronnych metali.
Wiemy już po ostatnim z tekstów, że wskutek różnicy potencjałów (wynikającej ze zróżnicowanej siły, z jaką atomy metali trzymają swoje elektrony), na powierzchni metalu mniej szlachetnego (o niższym potencjale) można osadzić warstewkę metalu bardziej szlachetnego. Proces ten jest napędzany dopóki ten mniej szlachetny metal oddaje temu drugiemu swoje elektrony. Ale kiedy będzie on już całkiem odcięty od roztworu przez metal szlachetniejszy (a wystarczy jego cieniutka lecz szczelna warstewka) jest już po zabawie. Choć nie do końca.
Pomyślmy przez chwilę. Paliwem w naszym przypadku są elektrony. One są bowiem potrzebne, by jony metalu szlachetnego mogły stać się obojętnymi atomami i osadzały się na tym mniej szlachetnym podłożu. Skąd więc brać dodatkowe elektrony? No przecież, one tworzą prąd elektryczny! Bingo! Czyli podłączamy przewody i do dzieła.

[Marie-Lan Nguyen, Public domain, via Wikimedia Commons]
Podłączając do prądu dostarczamy do układu elektronów. Nie wnikajmy chwilowo, czy ten prąd (czyli jak pamiętacie strumień elektronów) dostarczamy z baterii (ogniwa chemicznego) czy z prądnicy (alternatora). Pamiętajmy jednak, prawa natury są nieubłagane, i w ostatecznym rozrachunku skądś te elektrony musimy brać. Czy bateria, czy prądnica, właściwie nie tworzy elektronów w obwodzie elektrycznym, ale ukierunkowuje ich ruch i nadaje im energię (wytwarza napięcie w pewnym sensie). A to ile dane źródło prądu może ukierunkować elektronów mówi nam jakie natężenie prądu może to źródło wygenerować.
Jak pisałem, przemiana jonów w obojętne atomy nie jest już w naszym układzie uzależniona od elektronów oddawanych przez metal mniej szlachetny. Jeśli jednak w jednym miejscu obwodu elektrycznego następuje przemiana jonów dodatnich (kationów) w obojętne atomy, to gdzieś indziej musi być miejsce gdzie obojętne atomy oddają elektrony by stać się kationami. Chemicy mówią, że w pierwszym wypadku zachodzi redukcja, a w drugim utlenianie (które to pojęcie generalnie z tlenem ma niewiele wspólnego, ale tak historycznie zostało). Pierwsze zachodzi w miejscu obwodu zwanym katodą, a drugi proces występuje na tzw. anodzie. Dużo Wam wyjaśni na pewno poniższy rysunek.
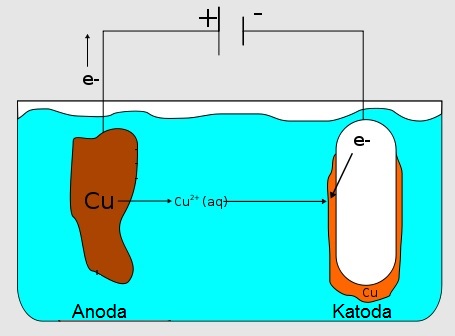
[na podstawie Maxiantor, via Wikimedia Commons]
W każdym razie wytwarzanie powłoki odbywa się kosztem metalu tworzącego anodę, ponieważ jego atomy stają się kationami i przechodzą do roztworu. Widzimy tego konsekwencje, ponieważ anoda podczas tego procesu dosłownie „znika w oczach”.
Ponieważ jony metalu, z którego chcemy mieć powłokę znikają z roztworu (bo stają się atomami tworzą tą warstewkę stałą), to dobrze jest, żeby anoda była właśnie z tego metalu, który osadzamy. Wtedy bilans jonów się zgadza, każdy osadzony jon metalu jest zastępowany przez ten powstający na anodzie.. I nie musimy się właściwie martwić jego potencjałem elektrochemicznym. Proces będzie trwał dopóki będziemy dostarczać prąd elektryczny. Czasem procesu możemy również regulować grubość warstewki jaka osadza się na katodzie. A więc całym procesem jesteśmy w stanie całkiem łatwo sterować.
Skupmy się na chwilę na naszych powłokach. Dotąd rozważaliśmy osadzanie się metalu bardziej szlachetnego na mniej szlachetnym. Dzięki temu możemy na przykład posrebrzyć czy pozłocić przedmioty z żelaza czy innego metalu o mniejszym potencjale. Zalety takie procesu są dość oczywiste. Po pierwsze kwestia estetyczna (ładna nierdzewiejąca czy śniedziejąca powłoka) oraz funkcje ochronne (metal szlachetny nie pozwala utleniać się metalowi, który pokrywa).
Niestety ta druga funkcja ma sens jedynie, kiedy powłoka jest absolutnie szczelna. Wystarczy mała rysa, by w jej miejscu zaczął się dramatyczny proces, w którym mniej szlachetny metal utlenia się wielokrotnie szybciej, niż by to się działo bez jego kontaktu z metalem szlachetniejszym. W miejscu rysy powstaje bowiem mikroogniwo elektrochemiczne.
Nie będę teraz go opisywał, bo to wymaga osobnego wpisu (tak już jest, że „im dalej w las tym więcej drzew”). Proszę więc, byście tymczasem przyjęli, że tak po prostu jest, ewentualnie, Ci spośród Was, którzy już się o tym kiedyś uczyli, postarali się w wolnej chwili odświeżyć swoją wiedzę o ogniwach chemicznych.
Dziś chciałbym Wam jeszcze powiedzieć o jednej tego konsekwencji. Otóż aby uniknąć takiego procesu, można stosować powłoki z mniej szlachetnych metali, np. z cynku na żelazie (np. stali). Ponieważ proces nie jest samorzutny zachodzi on tylko przy podłączeniu do prądu elektrycznego. W konsekwencji dostajemy powłokę, która w razie przerwania (np. zarysowania) będzie się utleniała (roztwarzała) kosztem będącego głębiej metalu.

[Atoma, CC BY 2.5 via Wikimedia Commons]
Co więcej niektóre powłoki mniej szlachetne są paradoksalnie trwalsze same w sobie od warstewek bardziej szlachetnych metali. Mogą one bowiem ulegać tzw. pasywacji, to znaczy pokrywać się na powietrzu warstewką tlenku, która jest na tyle szczelna, że nie dopuszcza do dalszego utlenienia się metalu powłoki, jak i metalu tą powłoką pokrytego. Ale dlaczego ten proces zachodzi to temat osobny, na razie dam Wam trochę odpocząć od elektrochemii 😉
Wojciech Smułek
