Niezmiennym elementem nauki chemii w szkole są zagadnienia związane z pH roztworów wodnych. Po omówieniu czym są kwasy i zasady przychodzi czas właśnie na skalę pH. Ponieważ jest to omawiane już w szkole podstawowej (a przez pewien czas było w gimnazjum), to można założyć, że każdy musiał się z tymi zagadnieniami zapoznać. Z nimi i ze słynnym papierkiem lakmusowym.
Myślę, że określenie „słynny” jest jak najbardziej uprawnione. Pojęcie „papierka lakmusowego” weszło bowiem na dobre do języka potocznego oznaczając coś (jakieś zdarzenie, zjawisko czy stosunek do czegoś), na podstawie czego możemy wnioskować o czymś większym lub bardziej ogólnym. Innymi słowy to indykator, wskaźnik, czy, jak dawniej mówiono probierz.
Wróćmy jednak do naszego papierka lakmusowego i jego użycia w chemii. Pierwsze co należy zaznaczyć, to że bardzo często jest on mylony z papierkiem uniwersalnym, który również jest stosowany do oznaczania kwasowości roztworu. Papierek uniwersalny, jak sama nazwa wskazuje, ma o wiele większy zakres stosowania, ponieważ zmienia barwy w szerszym zakresie niż papierek lakmusowy.

[Kiyok, CC BY-SA 3.0, via Wikimedia Commons]
Papierek uniwersalny jest zielono-żółty w neutralnym pH (dla przypomnienia – równym 7) a im bardziej kwasowy roztwór (niższe pH) tym jego barwa poprzez żółtą i pomarańczową staje się czerwona. Z kolei wzrost pH (a więc rosnące właściwości zasadowe) prowadzą do zmiany barwy na ciemnozieloną a następnie niebiesko-granatową. Pozwala to ocenić wartość pH z dokładnością do jednej-dwóch jednostek.
Papierek lakmusowy nie ma tak bogatego zakresu barw. W środowisku kwasowym (poniżej pH 4,5) jest czerwony, a w zasadowym (powyżej pH 8,3) niebieski. Między tymi wymienionymi wartościami pH papierek ma barwę pośrednią, a więc fioletową. Jest więc on skuteczny do wykrywania kwasów i zasad, ale na dokładniejsze określenie pH jednak nie pozwala. Jakkolwiek papierek lakmusowy przez wiele dekad był bardzo użytecznym i powszechnym narzędziem oceny kwasowości/zasadowości. Ta jego powszechność przyczyniła się do tego, że do dziś w podręcznikach nadaje się skali pH kolor od czerwonej (dla kwasów) po niebieską (dla zasad).
[Chemicalinterest, Public domain, via Wikimedia Commons]
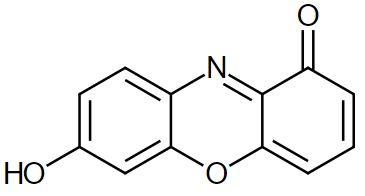
Czym jednak jest lakmus, którym nasącza się papierki lakmusowe? Wbrew dość rozpowszechnionemu mniemaniu nie jest to jednak konkretna substancja, a mieszanina kilkunastu różnych związków chemicznych. Spośród nich główną frakcję stanowią pochodne 7-hydroksyfenoksazonu, trójcyklicznego związku aromatycznego, i to właśnie one reagując z jonami wodorowymi zmieniają barwę z niebieskiej na czerwoną (a jaki mechanizm odpowiada za taką zmianę barwy to opowiem w jednym z kolejnych tekstów). Co ciekawe, lakmus w postaci wysuszonego proszku ma barwę niemal czarną.
Skąd jednak pomysł, by zmieszać kilkanaście związków chemicznych by uzyskać wskaźnik kwasowości roztworu? Właściwie to jego autorem jest przyroda. Lakmus bowiem jest mieszaniną związków, które można ekstrahować z kilku różnych gatunków porostów, m.in. tych należących do rodzin Roccella i Parmelia.
[Michał Sobkowski, Public domain, via Wikimedia Commons]
Pierwotnie był on stosowany do barwienia na niebiesko tkanin przez wikingów, którzy w swoich północnych krainach nie mieli za wiele roślin bogatych w naturalne barwniki i dlatego posiłkowali się niepozornymi porostami. Właśnie od staronordyckiego słowa litmus, oznaczającego barwnik, pochodzi nazwa lakmusu. Dodam jeszcze, że jedną z pierwszych pisemnych wzmianek o jego użyciu przypisuje się hiszpańskiemu lekarzowi, Arnaldusowi de Villa Nova, żyjącemu na przełomie XIII i XIV wieku, a w wieku XVI w. produkcja lakmusu jako barwnika miała już charakter masowy, kiedy więc odkryto potem jego właściwości zmiany barwy w zależności od kwasowości roztworu wydawał się bardzo praktycznym (i względnie tanim) odczynnikiem. Co ciekawe, lakmus jest na liście dozwolonych dodatków do żywności pod symbolem E121.

[Kristian Peters — Fabelfroh 09:10, 3 October 2006 (UTC), CC BY-SA 3.0 via Wikimedia Commons]
Na koniec jeszcze krótko o kilku innych „papierkach” stosowanych w chemii. Spośród wskaźników pH znany jest jeszcze papierek Kongo, który nasączony barwnikiem (czerwienią Kongo), który poniżej pH 3 staje się z czerwonego niebieski (a więc dokładnie na odwrót niż lakmus). Stosuje się jeszcze papierek jodoskrobiowy, który jak sama nazwa wskazuje zawiera bezbarwne jony jodkowe i skrobię. W warunkach silnie utleniających jony jodkowe I– utleniają się do pierwiastkowego jodu (I2), który ze skrobią tworzy ciemnogranatowe kompleksy. Papierek jodoskrobiowy pozwala więc na wykrywanie utleniaczy.
Z kolei papierek kobaltowy służy do wykrywania wilgoci. Wykorzystuje się w nim zjawisko polegające na zmianie barwy soli kobaltu w zależności od tego czy tworzą uwodnione czy też bezwodne kryształy. Uwodnione mają barwę fioletowo-różową a bezwodny niebiesko-granatową. Skądinąd to samo zjawisko jest wykorzystane w„pogodynkach” znanych (przynajmniej za moich dziecięcych lat) ze sklepów z pamiątkami. Mam tu na myśli figurki pokryte właśnie solami kobaltu, które w zależności od wilgotności powietrza zmieniały barwę z niebieskiej na fioletową. A czy to pomaga w przewidywaniu pogody? Odpowiedź na to pytanie zostawię już raczej meteorologom… 😉
Wojciech Smułek
29.11.2021 r.
