Pisząc o sodzie nie mogę sobie odmówić przyjemności opowiedzenia Wam o procesie jej otrzymywania. Po pierwsze dlatego, że jest on tak prosty a zarazem przemyślany, że doprowadzony przez lata do perfekcji pod względem efektywności, a po drugie, że nie wiem, czy wiecie, ale Polska sodą stoi, bo jesteśmy jej największym europejskim producentem (i eksporterem), co zapewniają dwa wielkie zakłady przemysłowe – jeden w Janikowie i drugi w Inowrocławiu-Mątwach.
[Macdriver (Bartek Wawraszko), via Wikimedia Commons]
Kiedy spojrzycie na mapę, lokalizacja tych dwóch zakładów jest dość specyficzna, bowiem sąsiadują ze sobą w odległości kilkunastu kilometrów i to w takim rejonie Polski, który nie jest jakoś szczególnie kojarzony z przemysłem chemicznym (jak na przykład Górny Śląsk). Rzecz w tym, że właśnie na Kujawach są szczególne warunki, polegające na tym, że obok nieopodal siebie występują złoża dwóch podstawowych surowców, czyli soli kamiennej/kuchennej (NaCl) i wapienia (CaCO3). Dodatkowo przy obu zakładach przebiega tak zwana magistrala węglowa, czyli linia kolejowa łącząca śląskie kopalnie węgla z portami Trójmiasta, a więc paliwo do procesu też jest tam stosunkowo łatwo dostępne.
Myliłby się jednak ten, kto by liczył na prostą reakcję w stylu:
2NaCl + CaCO3 → Na2CO3 + CaCl2
O nie, nie. Choć jest ona poprawna pod względem zapisu, to jest właściwie niemożliwa do zrealizowania. Po pierwsze dlatego, że wapień, w przeciwieństwie do soli kamiennej, jest praktycznie nierozpuszczalny w wodzie, a po drugie zarówno węglan sodu jak i chlorek wapnia są bardzo dobrze rozpuszczalne w wodzie, więc ciężko je rozdzielić, gdy występują razem. Musi być więc jakiś etap lub etapy pośrednie, które zrealizują tę reakcję, ale w kilku krokach. Pozwólcie więc, że je teraz po krótce opiszę.
Najpierw następuje przygotowanie solanki, czyli wodnego roztworu soli. W przypadku naszych zakładów produkcyjnych, o których wspomniałem, jest to sprawa o tyle prosta, że wydobycie soli w rejonie Inowrocławia odbywa się poprzez wypłukiwanie złóż wodą, tak że „urobkiem” jest wypompowywana na powierzchnię solanka. Należy jedynie znormalizować jej stężenie i wytrącić zanieczyszczenia, a potem, co istotne dla procesu, nasycić ją amoniakiem (NH3). Odbywa się to w specjalnych aparatach – wysokich na kilkanaście lub kilkadziesiąt metrów kolumnach, w których od góry po kratownicach spływa solanka a od dołu podawany jest gazowy amoniak. W konsekwencji u dołu kolumny odbierany jest nasycony tym gazem roztwór soli.
[Wikimedia Commons]
Równolegle trwa obróbka wapienia, który jest wydobywany nieopodal zakładów w okolicach Pakości i Barcina. Skała wapienna jest prażona (kalcynowana) w piecach opalanych koksem (dla niewtajemniczonych – to odgazowany i odsiarczony węgiel) dając w rezultacie wapno palone i dwutlenek węgla. Ale nie jest on oddawany do atmosfery, co to to nie. Jest on kierowany do przygotowanej wcześniej solanki amoniakalnej. Następuje więc tzw. karbonizacja, prowadzona zasadniczo w analogicznych aparatach jak nasycanie amoniakiem.
Roztwór po karbonizacji jest już gotowy do wytrącenia kryształów wodorowęglanu sodu, co odbywa się w wielkich kadziach (krystalizatorach) połączonych z filtrami, na których oddziela się soda oczyszczona. Może ona być odebrana jako gotowy produkt albo jest poddawana kalcynacji i staje się sodą kalcynowaną. Wydzielony w tym procesie dwutlenek węgla jest kierowany z powrotem do kolumn karbonizacyjnych.
Ostatnim etapem jest regeneracja amoniaku, który w postaci jonów amonowych pozostał w roztworze po odfiltrowaniu sody oczyszczonej (ten roztwór to tak zwany ług macierzysty). W tym celu miesza się go z wapnem palonym otrzymanym wcześniej podczas prażenia wapienia. Ulatnia się gazowy amoniak a w roztworze pozostają jony wapniowe i chlorkowe, które krystalizują jako chlorek wapnia.
Zobaczcie, że w ten sposób zrealizowaliśmy opisaną wyżej reakcję, jakkolwiek nie w jednym bezpośrednim procesie. Zwróćcie uwagę na kluczową rolę dwóch gazów, dwutlenku węgla i amoniaku, które są transportowane między poszczególnymi etapami. Szczególnie interesująca jest kwestia amoniaku, który teoretycznie nie zużywa się w procesie. Oczywiście pewne straty zawsze są, ale w ilości znikomej w porównaniu do setek tysięcy ton rocznie produkowanej sody. Cały proces odbywa się więc w systemie ciągłym, po prostu w różnych miejscach zakładów (które zajmują powierzchnię wielu hektarów) prowadzone są równolegle poszczególne etapy procesu.
Spójrzcie jeszcze na schemat ukazujący jakim przemianom ulegają poszczególne związki w procesie. Myślę, że bardzo dobrze oddaje on finezję procesu:
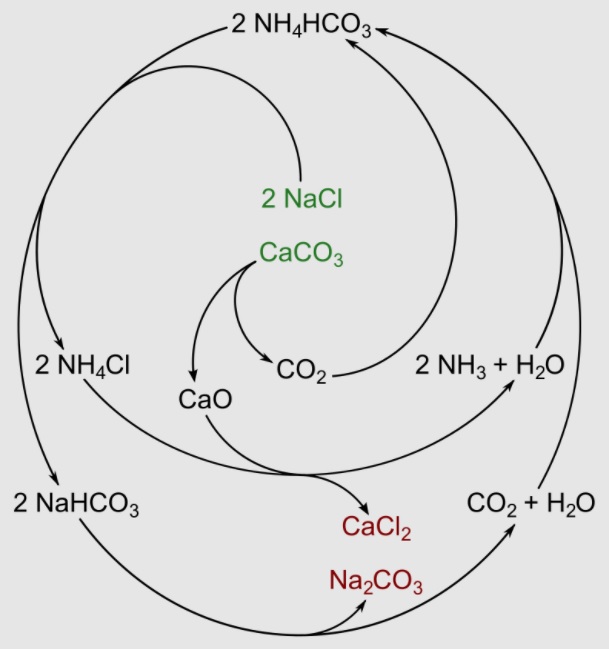
[Sponk (talk) (Vectorization), via Wikimedia Commons]
Na koniec jeszcze wspomnę o nazwie tej metody otrzymywania sody, który jest określana procesem Solvaya. Opracowali ją w połowie XIX w. dwaj pochodzący z Belgii bracia nazwiskiem Solvay, z których bardziej znany jest Ernest, który stał się bogatym przemysłowcem hojnie wspierającym wiele instytucji naukowych. On również zapoczątkował organizację tzw. Kongresów Solvaya, konferencji gromadzących najwybitniejszych fizyków i chemików. Na pierwszym z nich były na przykład takie osobistości jak Albert Einstein czy Maria Skłodowska-Curie. Jako ostatnią ciekawostkę dodam, że najbliższy kongres odbędzie się w maju 2022 roku, a część wykładów będzie dostępna on-line dla każdego chętnego 😉
Wojciech Smułek
