„Jeden, by wszystkimi rządzić, Jeden, by wszystkie odnaleźć,
Jeden, by wszystkie zgromadzić i w ciemności związać”
Tak tajemniczy pierścień opisuje w swojej powieści „Władca Pierścieni” J. R.R. Tolkien. Powieść oraz jej filmowa adaptacja mają do dziś niezliczone rzesze fanów. Wobec tego fenomenu nie mogli przejść obojętnie literaturoznawcy i historycy, którzy napisali tysiące tekstów opisujących dogłębnie to dzieło i podających setki jego interpretacji.
Zapyta ktoś, a co ma piernik do wiatraka, to znaczy co ma chemik do tolkienowskiej epopei. Czy chodzi o magię, tajemnicze eliksiry i mikstury, które skądinąd w tej powieści aż tak istotne dla fabuły nie są? Ależ nie, skojarzenie jest dużo bardziej odległe a zarazem bezpośrednie. Mam na myśli pierścienie i, mówiąc to całkiem szczerze, chemików organików, którzy w pełni zasługują na miano „Władców pierścieni”. Pewnie już się domyślacie, że owe pierścienie, to dokładnie pierścienie aromatyczne.
Przypatrzmy się najbardziej znanemu związkowi zawierającemu pierścień aromatyczny, czyli benzenowi. W gruncie rzeczy nie tyle jego cząsteczka zawiera pierścień aromatyczny, co jest z nim tożsamy. Struktura jego jest tak powszechnie znana, że w pewnym sensie jest ikoną całej chemii: pierścień z sześciu atomów węgla, z których każdy łączy się z dokładnie jednym atomem wodoru. Schody zaczynają się wtedy, kiedy zaczniemy się zastanawiać nad tym, jak wyglądają wiązania między sąsiadującymi ze sobą atomami węgla.
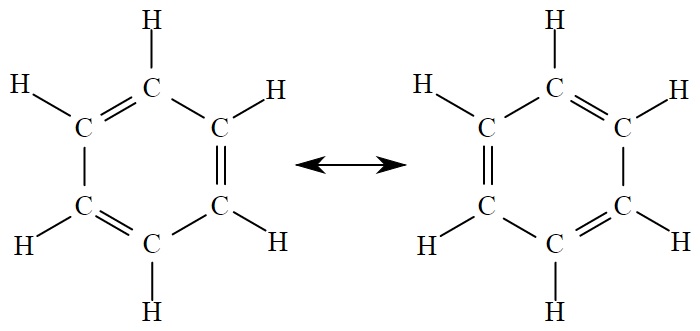
[Public domain, via Wikimedia Commons]
Pamiętamy, że węgiel ma cztery elektrony walencyjne. Może więc utworzyć cztery wiązania, przy czym mogą one być pojedyncze lub wielokrotne (podwójne albo potrójne). Po chwili namysłu możemy więc stwierdzić, że w benzenie co drugie wiązanie musi być podwójne. Co bardziej dociekliwi zapytają jednak: „a między którymi atomami one występują”? Spójrzcie bowiem na ilustrację powyżej – czy zawsze musi być tak, że wiązanie podwójne jest między atomami węgla (licząc od góry, zgodnie z ruchem wskazówek zegara) nr 1 i 2, dalej 3 i 4, oraz 5 i 6? A dlaczego nie na odwrót: 2 i 3, 4 i 5, 6 i 1?
Nie jest odpowiedzią stwierdzenie „obojętne”. O nie, wyobraźmy sobie, że choćby jeden z atomów wodoru w cząsteczce podmienimy np. atomem chloru i widzimy, że każdy z atomów węgla w pierścieniu jest inny, ponieważ znajduje się w innej odległości od atomu chloru (mówiąc ogólniej od „podstawnika” chlorowego).
Jeśli my mamy taki dylemat, który atom węgla z którym ma się połączyć, to cóż dopiero same atomy. My to sobie możemy podywagować, ale na ich poziomie to sprawa niezwykle poważna. W grę wchodzą siły atomowe i międzyatomowe, oddziaływania elektrostatyczne, a więc to nie przelewki. Natura wydała więc wyrok niemal salomonowy – wszystkie trzy wiązania w pierścieniu są ZDELOKALIZOWANE!
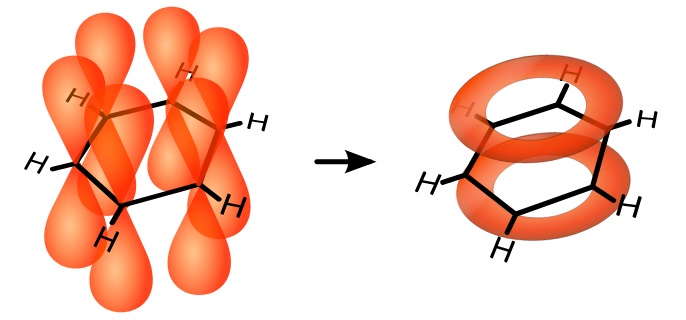
[Vladsinger, CC BY-SA 3.0, via Wikimedia Commons]
Nie chodzi nawet o to, że wiązania te nie są przypisane to konkretnych par atomów węgla i że raz są wiązania między atomami 1-2, 3-4, 5-6, a w ułamku sekundy powstają między atomami 2-3, 4-5, 6-1. Nie, nie. Każdy z atomów węgla uwspólnia po jednym elektronie walencyjnym (czyli w konsekwencji tworzy wiązanie) ze wszystkimi pozostałymi atomami!
To ma szalenie ważne konsekwencje. Nade wszystko taki układ staje się niezwykle stabilny. Nie ulega na przykład takim reakcjom jak inne węglowodory nienasycone (zwierające wiązania podwójne), które są stosunkowo reaktywne. Co więcej, struktura przestrzenna pierścienia jest idealnie płaska, co również wpływa na jego oddziaływanie z innymi, mniejszymi lub większymi, cząsteczkami. Pierścień aromatyczny ulega reakcjom w sposób wysoce specyficzny i wyjątkowy.
Przede wszystkim związki aromatyczne nie ulegały addycji, jak to jest w przypadku związków nienasyconych (o wiązaniach wielokrotnych), ale za to poddawały się substytucji (czyli jeden lub więcej atomów wodoru mógł być podmieniony innym atomem lub grupą atomów). Okrycie związków aromatycznych i ich właściwości było dla chemii organicznej niczym odkrycie Ameryki przez Kolumba. Otworzyło niezmierzone nowe możliwości, które do dziś pozostają nie do końca poznane.
W tym miejscu należy jednak poczynić ważne zastrzeżenie. Bezkresnej rodziny związków aromatycznych nie można zredukować tylko do pochodnych benzenu. Choćby dlatego, że układy aromatyczne mogą być skondensowane (policykliczne). To znaczy, że mogą występować połączone ze sobą bezpośrednio, jak w cząsteczce naftalenu, antracenu czy pirenu. Zaliczamy je do tak zwanych wielopierścieniowych węglowodorów aromatycznych (w skrócie WWA lub PAH z ang. polycyclic aromatic hydrocarbons).
WWA mają nie najlepszą renomę. Większość z nich jest toksycznych i rakotwórczych. Należy do nich m.in. benzopiren, występujący w kilku formach izomerycznych. Jego zawartość w powietrzu jest jednym ze wskaźników jakości powietrza, podawaną publicznie szczególnie w czasie zimowych smogów. Teraz nie chciałbym wchodzić w temat WWA głębiej, ale obiecuję, że wkrótce do niego wrócę w którymś z moich kolejnych tekstów.
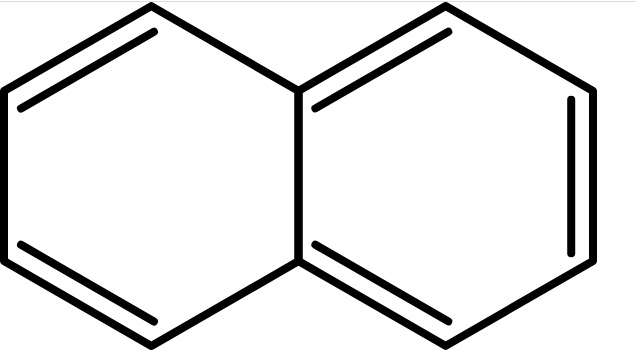
[Alberrosidus, Public domain, via Wikimedia Commons]
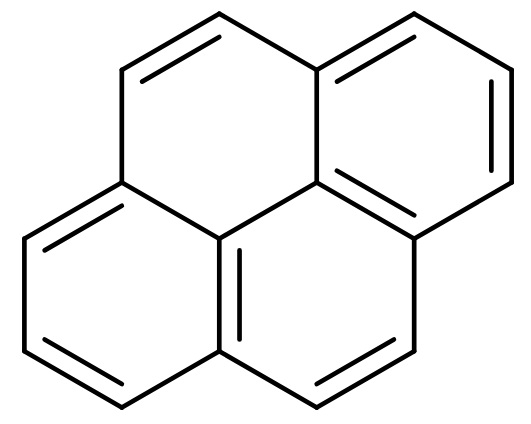
[Inductiveload, Public domain, via Wikimedia Commons]
Żeby przejść do kolejnej grupy związków aromatycznych musimy najpierw przyjrzeć się pojęciu aromatyczności. Nie ma ono zbyt dużo wspólnego z zapachem, choć prawdą jest, że pierwsze izolowane związki aromatyczne charakteryzowały się silnym aromatem. Pojęcie to zmieniło swoje znaczenie, kiedy zaczęto odkrywać kolejne grupy związków (niekoniecznie już pachnących), które wykazywały właściwości bliskie pierścieniowi benzenowemu, ale zbudowane nie tylko z węgla i wodoru, ale także np. z tlenu i azotu.
Dogłębne badania pokazały, że można wyróżnić dwie podstawowe cechy „aromatyczności” wybranych związków organicznych. Po pierwsze wyróżnia je budowa cykliczna (utworzenie pierścienia – zamkniętego łańcucha atomów, niekoniecznie sześciu, jak w przypadku benzenu). Po drugie płaska budowa cząsteczki, związana z powstaniem zdelokalizowanych wiązań chemicznych (zamiast „zwyczajnych” wiązań podwójnych).
A więc, proszę Państwa, mamy np. furan z tlenem lub pirydynę z azotem w pierścieniu. Zwróćmy przy tym uwagę, że w tych wypadkach te pierwiastki „uwspólniają” z pozostałymi atomami węgla nie jeden a całą parę wolnych elektronów walencyjnych. Tak czy inaczej powstają związki o właściwościach zbliżonych do benzenu, choć oczywiście nie identycznych. Istotne dla nas jest to, że mechanizmy reakcji są w tych przypadkach podobne.
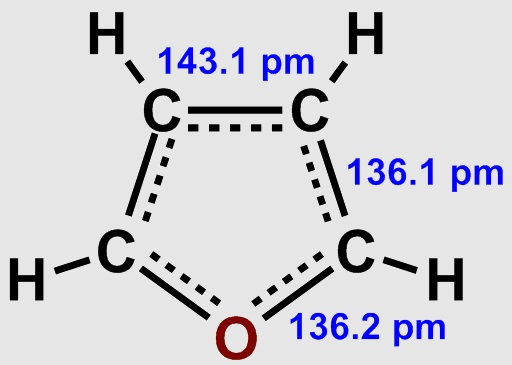
[Michał Sobkowski, Public domain, via Wikimedia Commons]
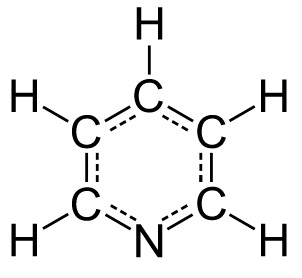
[Jynto, Public domain, via Wikimedia Commons]
Jako swoistą „wisienkę na torcie” podam informację, że istnieją również nieorganiczne związki aromatyczne, o podobnych właściwościach. Przykładem jest borazyna, jak benzen posiadająca sześcioatomowy pierścień z przyłączonymi atomami wodoru, ale który tworzą ułożone naprzemiennie atomy boru i azotu. Ciekawa struktura, czyż nie?
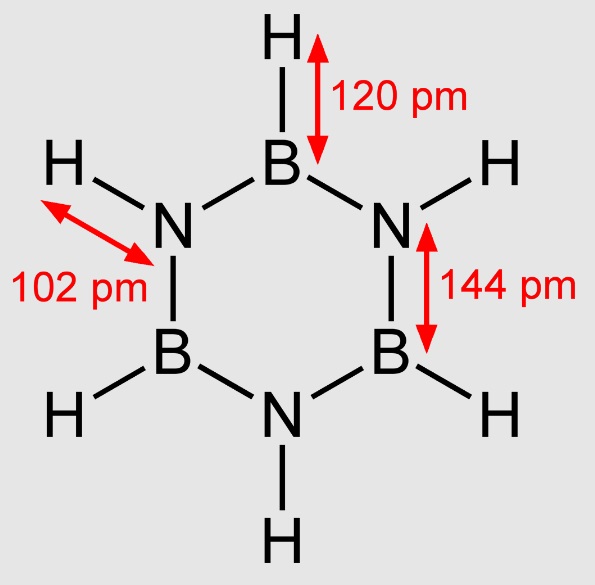
[Benjah-bmm27, Public domain, via Wikimedia Commons]
Chemicy mają więc całkiem sporo, a właściwie nieskończenie wiele, pierścieni do dyspozycji. Każdy z nich posiada w sobie olbrzymią moc i potencjał niezwykłych właściwości. Dlatego uważam, że w pełni zasługujemy na miano prawdziwych „Władców pierścieni”!
Wojciech Smułek
