Wolne rodniki, czyli zło wcielone. Krążą po naszym organizmie przyczyniając się do nowotworów i innych chorób, a nade wszystko przyspieszają starzenie powodując zmarszczki, wypadanie włosów i mnóstwo innych strasznych rzeczy. Pewnie to już nie raz słyszeliście, bowiem przypomina o tym co trzecia reklama kosmetyków i suplementów diety.
Większość ludzi wie, że reklama to nie jest najlepsze źródło wiedzy o świecie, niemniej „coś w tym musi być”. Pójdźmy więc dalej i nie poprzestawajmy na marketingowych sloganach. Zapoznajmy się z rodnikami nieco bardziej.
Krótko o wiązaniach chemicznych
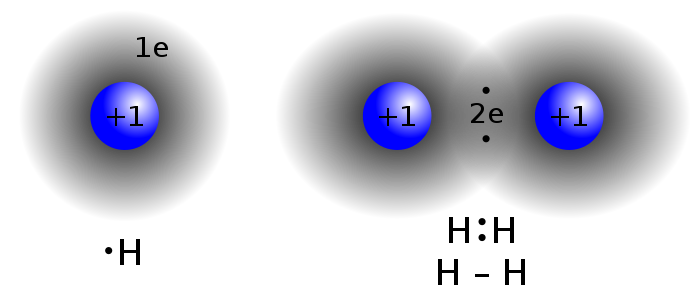
Najpierw musimy sobie przypomnieć, na czym polega tworzenie wiązań chemicznych. Zasadniczo występują trzy rodzaje wiązań – kowalencyjne, koordynacyjne i jonowe. Trudno jednoznacznie określić, które jest najpowszechniejsze, my jednak skupmy na tym pierwszym. Powstaje ono, kiedy dwa atomy uwspólniają swoje elektrony walencyjne (czyli te krążące po orbitach najdalszych od jądra atomu).
Każdy z atomów „oddaje” na rzecz wiązania po jednym elektronie. Taka para elektronowa zaczyna krążyć już nie wokół jednego jądra atomowego, ale wokół jąder obu atomów. Tak powstaje wiązanie pojedyncze, jak na przykład w cząsteczce wodoru H2. Jeśli atomy uwspólnią po dwa lub trzy elektrony walencyjne i utworzą dwie lub trzy pary elektronowe krążące wokół jąder obu atomów, to mamy do czynienia z wiązaniem podwójnym (np. w cząsteczce tlenu O2) lub potrójnym (sztandarowym przykładem jest cząsteczka azotu, N2).
Rozrywanie wiązań
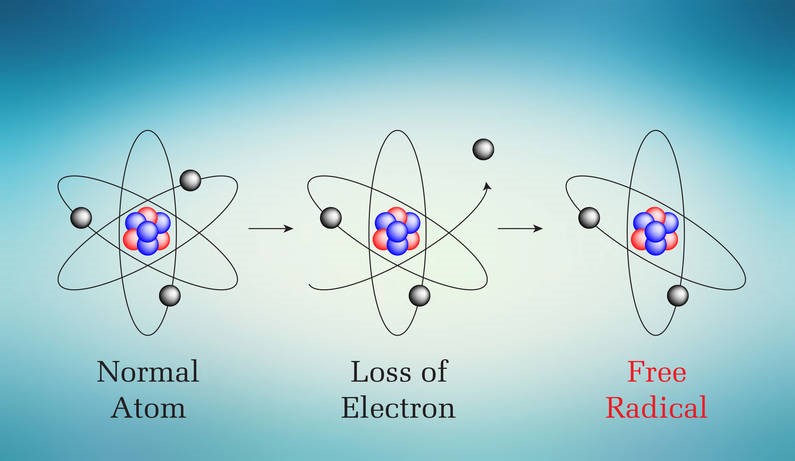
Zwykle rozerwanie wiązania (np. w trakcie jakiejś reakcji chemicznej) odbywa się tak, że para elektronowa pozostaje przy jednym z atomów, który ma wtedy więcej elektronów niż protonów w jądrze i staje się ujemnie naładowanym jonem, anionem. Drugi atom, uboższy o elektron walencyjny, przyjmuje ładunek dodatni, zostaje kationem.
Czasem jednak dochodzi do pęknięcia wiązania w taki sposób, że każdy z atomów otrzymuje po jednym elektronie z wiązania. Niby sytuacja wraca do punktu wyjścia, ale to wcale nie jest „komfortowa” sytuacja, jeśli dany elektron nie jest sparowany. Wynika to z rozkładu energii orbitali elektronowych, która wtedy nie jest zbyt korzystna1. Taki atom (lub fragment cząsteczki, bo nie jest powiedziane, że odrywa się zawsze pojedynczy atom) z niesparowanym elektronem to właśnie (wolny) rodnik.
Szybki jak wolny rodnik
Wbrew nazwie wolne rodniki, wcale powolne nie są. Wręcz przeciwnie, są bardzo reaktywne i szybko wchodzą w reakcje chemiczne. Mówimy o nich „wolne” w znaczeniu „niezwiązane, swobodne”. Anglosasi z kolei nie mają tego problemu, nazywają je bowiem „free radicals”, a nie „slow radicals”, w języku polskim jednak słowo „wolny” jest zdecydowanie dwuznaczne.
Wspomniana wysoka reaktywność rodników wynika z tego, że dzięki obecności niesparowanego elektronu rodnik będzie chciał jak najszybciej znaleźć sobie inny elektron „do pary” i utworzyć wiązanie chemiczne. To jest właśnie przyczyna szkodliwości rodników, ponieważ mogą one reagować nawet ze stosunkowo biernymi chemicznie związkami oraz biocząsteczkami, jak białka czy DNA. W konsekwencji zmieniają ich strukturę i właściwości, a w przypadku DNA oznacza to także mutacje genetyczne.
Należy się tu jednak słowo wyjaśnienia. W naszym organizmie cały czas powstają wolne rodniki i część z nich jest wręcz niezbędna do funkcjonowania żywych komórek i ich zbyt małe stężenie też jest złe. Niemniej ich nadmiar jest bardzo niekorzystny i mają swój udział m.in. w procesach starzenia. Jakkolwiek trzeba wiedzieć, że jest zjawisko starzenia jest zbyt złożone, aby było zależne tylko od nadmiaru wolnych rodników.
Powstawanie rodników
Powiedzmy jeszcze dwa słowa o powstawaniu rodników. Do rozerwania wiązań kowalencyjnych trzeba naprawdę dużo energii. Stąd do powstawania wolnych rodników dochodzi w warunkach „wysokoenergetycznych”, czyli w wysokich temperaturach lub pod wpływem promieniowania elektromagnetycznego o krótkich falach, np. promieniowania ultrafioletowego 2.
Powstawanie rodników zależy także od struktury chemicznej cząsteczki, ponieważ jedne związki chemiczne tworzą rodniki stosunkowo łatwo, a inne praktycznie w ogóle. Do tej pierwszych należą np. nadtlenki, w tym nadtlenek wodoru, którego 3% roztwór to tzw. woda utleniona.
Na koniec warto wspomnieć, że bardzo wiele reakcji szeroko stosowanych w przemyśle chemicznym to rekcje rodnikowe. Chyba najpowszechniejsze to reakcje polimeryzacji rodnikowej, np. ATRP (ang. atom transfer radical polymerization – polimeryzacja rodnikowa z przeniesieniem atomu) 3. W ten sposób otrzymuje się polimery takie jak polistyren (w wersji spienionej to tzw. styropian) oraz poli(metakrylan metylu) (tzw. pleksa, szkło akrylowe).
Nie takie złe więc te rodniki jak je malują, a wręcz przeciwnie, bywają bardzo pożyteczne.
Wojciech Smułek
- Niektórzy pamiętają może z lekcji chemii tzw. Regułę oktetu, czyli zasadę, że atomy chcą mieć na zewnętrznej orbicie po osiem elektronów walencyjnych. Wtedy rozkład energii elektronów jest optymalny. Dodam jeszcze, że ta reguła oktetu to uproszczona zasada. Elektrony tak w gruncie rzeczy nie krążą po takich jednoznacznych orbitach, jak np. planety wokół Słońca). Mamy do czynienia raczej z „chmurami ładunku ujemnego”, ale to dłuższa historia. ↩
- Jak pamiętamy im krótsza fala elektromagnetyczna tym większa energia fotonów, które ją tworzą. ↩
- Wyjaśnienie mechanizmu tej reakcji to zasługa wybitnego polskiego chemika Krzysztofa Matyjaszewskiego (1950- ). ↩
